汽車尾氣中NOx(NO、NO2等)是形成霧霾及硝酸型酸雨的大氣污染物之一。
(1)①尿素[CO(NH2)2]在一定條件下可以直接還原NO生成N2,發生反應的化學方程式為2CO(NH2)2+6NO一定條件下5N2+2CO2+4H2O2CO(NH2)2+6NO一定條件下5N2+2CO2+4H2O。
②尿素水溶液高于160℃時水解生成NH3和CO2,可作為處理NO反應的氨源。通過調整尿素噴入量與汽車尾氣流速,得到相同時間內不同投料比[n(尿素)n(NO)]時NO的轉化率隨溫度變化的a、b的兩條曲線如圖1所示。

ⅰ)曲線a和曲線b,投料比較大的曲線是aa。(選填“a”或“b”)
ⅱ)當200℃<T<450℃時,NO的轉化率隨溫度升高而增大,原因是溫度升高,隨著溫度升高,尿素水解釋放氨氣的速率加快,c(NH3)增大隨著溫度升高,尿素水解釋放氨氣的速率加快,c(NH3)增大反應速率加快。
(2)在催化劑Rh表面CO還原NO基元反應機理路徑如圖2所示,兩個N(s)結合生成的N2稱為β-N2,N2O(s)解離生成的N2稱為δ-N2,基元反應速率隨溫度的變化關系如圖3所示。
下列說法正確的是ABDEABDE。(填寫字母序號)
A.在催化劑表面NO的吸附并解離是反應發生的先決條件
B.在催化劑表面CO2的及時脫附有利于條件的進行
C.當溫度超過625K時,生成的N2主要是由CO還原N2O生成的
D.當溫度低于530K時,發生的主要反應為2NO+CO═N2O+CO2
E.尋找低溫下高效的催化劑控制汽車尾氣的污染是未來研究的方向
(3)利用汽車燃油不完全燃燒產物中的CO、HC(還原性的碳氫化合物)作還原劑,在三元催化器作用下可高效去除汽車尾氣中的NOx。
已知:可燃混合氣中空氣質量與燃油質量之比為空燃比。CO、HC及NOx轉化效率隨空燃比的變化關系如圖4所示。當空燃比>15時,NOx轉化率降低,其可能原因是O2含量較高,燃油能充分燃燒,產物中生成CO、HC的量較少,被還原的NOx的量減少,O2量增多,與氮氣生成生成的NOx的量增多。O2含量較高,燃油能充分燃燒,產物中生成CO、HC的量較少,被還原的NOx的量減少,O2量增多,與氮氣生成生成的NOx的量增多。。
一定條件下
一定條件下
n
(
尿素
)
n
(
NO
)
【答案】2CO(NH2)2+6NO5N2+2CO2+4H2O;a;隨著溫度升高,尿素水解釋放氨氣的速率加快,c(NH3)增大;ABDE;O2含量較高,燃油能充分燃燒,產物中生成CO、HC的量較少,被還原的NOx的量減少,O2量增多,與氮氣生成生成的NOx的量增多。
一定條件下
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:64引用:1難度:0.6
相似題
-
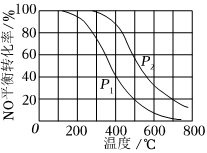 1.一定條件下,將NO(g)和O2(g)按物質的量之比2:1充入反應容器,發生反應:2NO(g)+O2(g)?2NO2(g)。其他條件相同時,分別測得NO的平衡轉化率在不同壓強 (p1、p2)下隨溫度變化的曲線如圖所示。下列說法正確的是( )
1.一定條件下,將NO(g)和O2(g)按物質的量之比2:1充入反應容器,發生反應:2NO(g)+O2(g)?2NO2(g)。其他條件相同時,分別測得NO的平衡轉化率在不同壓強 (p1、p2)下隨溫度變化的曲線如圖所示。下列說法正確的是( )A.p1<p2 B.其他條件不變,溫度升高,該反應的反應限度增大 C.400℃、p1條件下,O2的平衡轉化率為20% D.400℃時,該反應的化學平衡常數的數值為 109發布:2024/12/5 7:30:1組卷:245引用:9難度:0.5 -
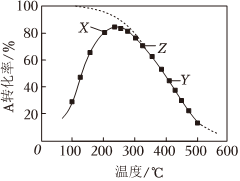 2.在2L的密閉容器中,2A(g)+B(g)?2C(g)ΔH,將2molA氣體和1molB氣體在反應器中反應,測定A的轉化率與溫度的關系如實線圖所示(圖中虛線表示相同條件下A的平衡轉化率隨溫度的變化)。下列說法正確的是( )
2.在2L的密閉容器中,2A(g)+B(g)?2C(g)ΔH,將2molA氣體和1molB氣體在反應器中反應,測定A的轉化率與溫度的關系如實線圖所示(圖中虛線表示相同條件下A的平衡轉化率隨溫度的變化)。下列說法正確的是( )A.反應2A(g)+B(g)?2C(g)的ΔH>0 B.X點的化學平衡常數大于Y點的化學平衡常數 C.圖中Y點v(正)>v(逆) D.圖中Z點,增加B的濃度不能提高A的轉化率 發布:2024/12/30 3:30:1組卷:91引用:7難度:0.5 -
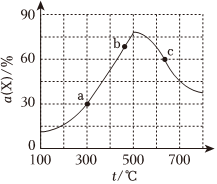 3.向1L的恒容密閉容器中加入1molX和2molY,發生反應:X(g)+2Y(g)?2Z(g),X的轉化率α隨溫度t的變化如圖所示(圖中不同溫度下的轉化率是第5min數據)。下列說法正確的( )
3.向1L的恒容密閉容器中加入1molX和2molY,發生反應:X(g)+2Y(g)?2Z(g),X的轉化率α隨溫度t的變化如圖所示(圖中不同溫度下的轉化率是第5min數據)。下列說法正確的( )A.300℃時,0-5min內平均反應速率v(Z)=0.3mol?L-1?min-1 B.b、c點對應的v逆(Y)大小關系:b>c C.c點時,反應消耗pmolX(p<1),同時消耗2pmolZ D.若將氣體體積縮小為0.5L,則c點溫度下的α(X)減小 發布:2024/12/30 4:0:1組卷:32引用:3難度:0.7


