利用NH3的還原性可以消除氮氧化物的污染,其中除去NO的主要反應(yīng)如下:4NH3(g)+6NO(g)?5N2(g)+6H2O(l),某研究小組將2molNH3、3molNO和一定量的O2充入2L密閉容器中,在催化劑(Ag2O)表面發(fā)生上述反應(yīng),NO生成N2的轉(zhuǎn)化率隨溫度變化的情況如圖所示.(轉(zhuǎn)化率=消耗量初始量×100%)
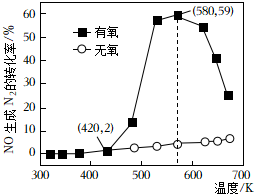
(1)在5min內(nèi),溫度從420K升高到580K,此時(shí)段內(nèi)NO生成N2的平均反應(yīng)速率v(NO)=0.171 mol?L-1?min-10.171 mol?L-1?min-1.
(2)在有氧條件下溫度580K之后NO生成N2的轉(zhuǎn)化率降低的原因可能是 平衡逆向移動(dòng)平衡逆向移動(dòng).
消耗量
初始量
【考點(diǎn)】轉(zhuǎn)化率隨溫度、壓強(qiáng)的變化曲線;反應(yīng)速率的定量表示方法.
【答案】0.171 mol?L-1?min-1;平衡逆向移動(dòng)
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書(shū)面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:17引用:1難度:0.6
相似題
-
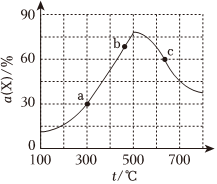 1.向1L的恒容密閉容器中加入1molX和2molY,發(fā)生反應(yīng):X(g)+2Y(g)?2Z(g),X的轉(zhuǎn)化率α隨溫度t的變化如圖所示(圖中不同溫度下的轉(zhuǎn)化率是第5min數(shù)據(jù))。下列說(shuō)法正確的( )
1.向1L的恒容密閉容器中加入1molX和2molY,發(fā)生反應(yīng):X(g)+2Y(g)?2Z(g),X的轉(zhuǎn)化率α隨溫度t的變化如圖所示(圖中不同溫度下的轉(zhuǎn)化率是第5min數(shù)據(jù))。下列說(shuō)法正確的( )A.300℃時(shí),0-5min內(nèi)平均反應(yīng)速率v(Z)=0.3mol?L-1?min-1 B.b、c點(diǎn)對(duì)應(yīng)的v逆(Y)大小關(guān)系:b>c C.c點(diǎn)時(shí),反應(yīng)消耗pmolX(p<1),同時(shí)消耗2pmolZ D.若將氣體體積縮小為0.5L,則c點(diǎn)溫度下的α(X)減小 發(fā)布:2024/12/30 4:0:1組卷:32引用:3難度:0.7 -
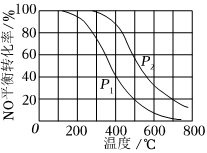 2.一定條件下,將NO(g)和O2(g)按物質(zhì)的量之比2:1充入反應(yīng)容器,發(fā)生反應(yīng):2NO(g)+O2(g)?2NO2(g)。其他條件相同時(shí),分別測(cè)得NO的平衡轉(zhuǎn)化率在不同壓強(qiáng) (p1、p2)下隨溫度變化的曲線如圖所示。下列說(shuō)法正確的是( )
2.一定條件下,將NO(g)和O2(g)按物質(zhì)的量之比2:1充入反應(yīng)容器,發(fā)生反應(yīng):2NO(g)+O2(g)?2NO2(g)。其他條件相同時(shí),分別測(cè)得NO的平衡轉(zhuǎn)化率在不同壓強(qiáng) (p1、p2)下隨溫度變化的曲線如圖所示。下列說(shuō)法正確的是( )A.p1<p2 B.其他條件不變,溫度升高,該反應(yīng)的反應(yīng)限度增大 C.400℃、p1條件下,O2的平衡轉(zhuǎn)化率為20% D.400℃時(shí),該反應(yīng)的化學(xué)平衡常數(shù)的數(shù)值為 109發(fā)布:2024/12/5 7:30:1組卷:245引用:9難度:0.5 -
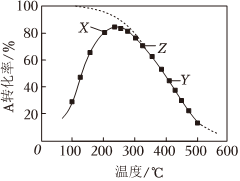 3.在2L的密閉容器中,2A(g)+B(g)?2C(g)ΔH,將2molA氣體和1molB氣體在反應(yīng)器中反應(yīng),測(cè)定A的轉(zhuǎn)化率與溫度的關(guān)系如實(shí)線圖所示(圖中虛線表示相同條件下A的平衡轉(zhuǎn)化率隨溫度的變化)。下列說(shuō)法正確的是( )
3.在2L的密閉容器中,2A(g)+B(g)?2C(g)ΔH,將2molA氣體和1molB氣體在反應(yīng)器中反應(yīng),測(cè)定A的轉(zhuǎn)化率與溫度的關(guān)系如實(shí)線圖所示(圖中虛線表示相同條件下A的平衡轉(zhuǎn)化率隨溫度的變化)。下列說(shuō)法正確的是( )A.反應(yīng)2A(g)+B(g)?2C(g)的ΔH>0 B.X點(diǎn)的化學(xué)平衡常數(shù)大于Y點(diǎn)的化學(xué)平衡常數(shù) C.圖中Y點(diǎn)v(正)>v(逆) D.圖中Z點(diǎn),增加B的濃度不能提高A的轉(zhuǎn)化率 發(fā)布:2024/12/30 3:30:1組卷:91引用:7難度:0.5
相關(guān)試卷


