近期,我國個別企業違法排污導致地下水嚴重污染又成為媒體焦點.對水的質量監控有很多指標,其中水中溶解氧(DO)的多少是衡量水體自凈能力的一個指標.
Ⅰ.對溶解氧(DO)的測定步驟是:
①在一定溫度下量取100.00mL新鮮水樣,在堿性條件下使其中的O2將Mn2+氧化為MnO(OH)2:
2Mn2++O2+4OH-═2MnO(OH)2
②向步驟①反應后的溶液中加入KI溶液,使其中生成的MnO(OH)2再還原成Mn2+:
MnO(OH)2+2I-+4H+═Mn2-+I2+3H2O
③最后用0.0100mol?L-1 Na2S2O3標準溶液滴定步驟②中生成的I2:I2+2S2O32-═S4O62-+2I-,消耗Na2S2O3標準溶液11.00mL.
(1)步驟③使用的指示劑是淀粉試液.滴定終點時指示劑的顏色變化情況是藍色變為無色且在半分鐘內不恢復藍色藍色變為無色且在半分鐘內不恢復藍色.
(2)硫代硫酸(H2S2O3)是一種二元弱酸.步驟③應選用堿式堿式滴定管進行滴定,結合離子方程式說明原因:硫代硫酸鈉為強堿弱酸鹽,硫代硫酸根水解使溶液呈堿性S2O32-+H2O═HS2O3-+OH-,會腐蝕酸式滴定管活塞(SiO2+2OH-=SiO32-+H2O)硫代硫酸鈉為強堿弱酸鹽,硫代硫酸根水解使溶液呈堿性S2O32-+H2O═HS2O3-+OH-,會腐蝕酸式滴定管活塞(SiO2+2OH-=SiO32-+H2O).
(3)水樣中溶解氧(DO)的濃度為8.88.8mg?L-1.
Ⅱ.該實驗需用Na2S2O3固體配制100mL 0.0100mol?L-1 Na2S2O3標準溶液.
(4)請按配制的過程填寫選用儀器的順序:④⑤①③②④⑤①③②(填編號).
①玻璃棒 ②膠頭滴管 ③100mL容量瓶 ④天平 ⑤25mL燒杯
(5)配制0.0100mol?L-1 Na2S2O3標準溶液時,下列操作使所配溶液濃度偏高的是BEBE.
A.沒有用蒸餾水洗滌燒杯
B.定容時俯視容量瓶刻度線
C.配制前容量瓶洗凈后沒干燥
D.搖勻后見液面下降,再加水至刻度線
E.用天平稱量藥品時,左盤低,右盤高.
【考點】中和滴定;配制一定物質的量濃度的溶液.
【答案】藍色變為無色且在半分鐘內不恢復藍色;堿式;硫代硫酸鈉為強堿弱酸鹽,硫代硫酸根水解使溶液呈堿性S2O32-+H2O═HS2O3-+OH-,會腐蝕酸式滴定管活塞(SiO2+2OH-=SiO32-+H2O);8.8;④⑤①③②;BE
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:87引用:5難度:0.5
相似題
-
1.下列實驗方法或操作正確的是( )
A.酸堿中和滴定時,右手旋轉滴定管的活塞,左手搖動錐形瓶,眼睛注視滴定管中的液面 B.用200mL燒杯配制物質的量濃度約為0.1000mol/L氫氧化鈉溶液200mL C.不用另加任何試劑就能鑒別NaAlO2、Na2SiO3、HCl、NaCl四種無色溶液 D.用托盤天平稱取1.6g硫酸銅晶體配制100mL 0.1mol/L的硫酸銅溶液 發布:2024/12/12 8:0:1組卷:9引用:1難度:0.7 -
2.食醋是日常飲食中的一種調味劑,國家標準規定釀造食醋中醋酸含量不得低于0.035g/mL,實驗室用標準NaOH溶液測定食醋中醋酸的濃度,以檢測食醋是否符合國家標準,某品牌白醋的醋酸濃度測定過程如圖所示,請回答:
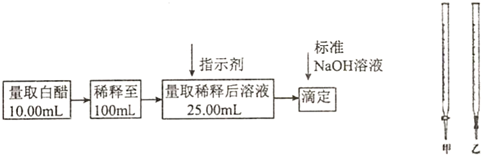
(1)選用上述(填“甲”或“乙”)滴定管量取10.00mL白醋后,將白醋稀釋至100mL時,需要使用的玻璃儀器有燒杯、玻璃棒和.
(2)某同學用酸堿中和滴定法測定該品牌白醋的醋酸濃度,當醋酸與氫氧化鈉恰好完全反應時,測得溶液中=c(CH3COOH)c(CH3COO-),則此時溶液中的pH=11.8×103.(已知:室溫下醋酸的Ka=1.8×10-5)
(3)根據該同學的計算結果,應該選作指示劑.(填“酚酞”、“甲基橙”或“石蕊”)
(4)該滴定達到終點時的現象是.
(5)某次實驗滴定開始和結束時,堿式滴定管中的液面如下圖所示,則所用NaOH溶液的體積為mL.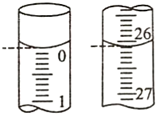
(6)用標準的0.06000mol?L-1NaOH溶液滴定上述稀釋后的醋酸溶液,滴定結果如下表所示:
則該品牌白醋中醋酸含量為滴定次數 待測溶液的體積/mL 標準溶液的體積 滴定前刻度/mL 滴定后刻度/mL 1 25.00mL 0.02 25.01 2 25.00mL 0.70 25.71 3 25.00mL 0.50 24.2 mg/mL.
(7)下列操作中,可能使所測白醋中醋酸的濃度數值偏高的是.(填編號)
A.取待測液的滴管,取液前滴定管尖嘴處無氣泡,取液后尖嘴處出現氣泡
B.滴定前盛放白醋稀溶液的錐形瓶用蒸餾水洗凈后沒有干燥
C.堿式滴定管未用標準NaOH溶液潤洗就直接注入標準NaOH溶液
D.讀取NaOH溶液體積時,開始時俯視讀數,滴定結束時仰視讀數
(8)有一支50mL的酸式滴定管,其中盛有溶液,液面恰好在10.00mL刻度處,現把管內液體全部放出,用量筒接收,得到溶液的體積是.
A.等于10mL
B.等于40mL
C.大于40mL
D.不能確定發布:2024/12/30 3:0:4組卷:54引用:2難度:0.6 -
3.下面關于中和滴定的實驗操作敘述不正確的有( )
①將錐形瓶用蒸餾水和待測定的鹽酸溶液進行洗滌
②取20mL待測定的鹽酸溶液,注入錐形瓶中
③向錐形瓶中加入幾滴酚酞試液為指示劑
④堿式滴定管用蒸餾水洗滌后,直接注入已知濃度的NaOH溶液
⑤進行中和滴定時,一旦錐形瓶內溶液由無色變成粉紅色,即可停止滴定
⑥記錄數據,進行必要的數據處理和得出結論A.①④⑥ B.①②④ C.①②④⑤ D.②③⑤ 發布:2024/12/10 0:30:1組卷:92引用:2難度:0.7


