金屬及其化合物在生產生活中應用廣泛。
(一)金屬的性質和應用
(1)人類使用金屬先后經歷了:“青銅”、“鐵器”時代,近代才開始大量使用鋁材料。這也反映出Cu、Fe、Al三種金屬的活動性不同,其由強到弱的順序是 鋁>鐵>銅鋁>鐵>銅。
(2)我國西漢就有“曾青得鐵則化為銅”之說,用化學方程式表示其原理 Fe+CuSO4=FeSO4+CuFe+CuSO4=FeSO4+Cu。
(3)鐵生銹主要與空氣中的 氧氣和水氧氣和水有關。
(4)如圖實驗說明NaCl在鐵生銹中的作用是 加速鐵的銹蝕加速鐵的銹蝕。
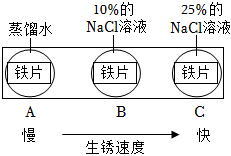
鐵生銹的主要過程為:
FeO2、H2O①Fe(OH)2O2、H2O②Fe(OH)3風吹日曬③Fe2O3?nH2O
(5)寫出Fe→Fe(OH)3的化學方程式 2Fe+O2+2H2O=2Fe(OH)2,4Fe(OH)2+O2+2H2O=4Fe(OH)32Fe+O2+2H2O=2Fe(OH)2,4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(6)鐵銹中一定含Fe2O3?nH2O,可能含FeCO3(FeCO3和稀HCl的反應與CaCO3相似),在某鐵銹樣品中加稀HCl,無氣泡冒出,溶液變為黃色無氣泡冒出,溶液變為黃色(填現象),證明不含FeCO3。
(二)鐵的化合物制備
用廢鐵屑制備鐵紅(主要成分為Fe2O3)的部分流程如圖所示:
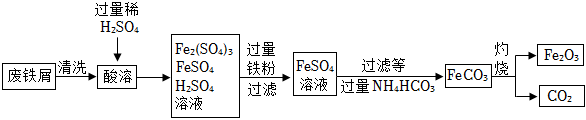
(7)清洗時利用洗滌劑的 乳化乳化作用,用其除廢鐵屑表面的油污。
(8)流程中加入的鐵粉除和H2SO4反應外,還和Fe2(SO4)3發生化合反應,此化合反應的化學方程式為 Fe+Fe2(SO4)3=3FeSO4Fe+Fe2(SO4)3=3FeSO4。
(9)加過量NH4HCO3反應時溫度不宜過高的原因為 防止NH4HCO3受熱分解防止NH4HCO3受熱分解。
(10)在空氣中灼燒FeCO3的反應為 4FeCO3+O2 △ 2Fe2O3+4CO24FeCO3+O2 △ 2Fe2O3+4CO2(寫化學方程式)。
(三)CH4還原Fe2O3的探究
取48.0gFe2O3粉末,用如圖裝置進行實驗,并對反應及產物等作探究。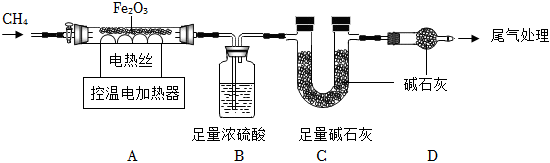
資料:①濃硫酸有吸水性,堿石灰可吸收H2O和CO2。②FeO+H2SO4═FeSO4+H2O。
(11)裝配好實驗裝置后,先要 檢查裝置氣密性檢查裝置氣密性。
(12)加熱前后及過程中均通入CH4,停止加熱后繼續通CH4的目的是防止倒吸和 防止產物遇空氣再被氧化防止產物遇空氣再被氧化。
(13)A中有如下反應:xCH4+4Fe2O3 高溫 8Fe+xCO2+yH2O,下列說法正確的是 aa(填序號)。
a、y=2x
b、裝置B、C增加的質量比為9:22
(14)控溫加熱一段時間后,繼續通CH4至冷卻,A中剩余的35.2g固體為Fe和FeO的混合物。在剩余固體中加一定量硫酸溶液,反應剛好完全。
①剩余固體中FeO質量為 7.27.2g。
②剩余固體和稀硫酸完全反應形成FeSO4的質量為 91.291.2g。
O
2
、
H
2
O
①
O
2
、
H
2
O
②
風吹日曬
③
△
△
高溫
【答案】鋁>鐵>銅;Fe+CuSO4=FeSO4+Cu;氧氣和水;加速鐵的銹蝕;2Fe+O2+2H2O=2Fe(OH)2,4Fe(OH)2+O2+2H2O=4Fe(OH)3;無氣泡冒出,溶液變為黃色;乳化;Fe+Fe2(SO4)3=3FeSO4;防止NH4HCO3受熱分解;4FeCO3+O2 2Fe2O3+4CO2;檢查裝置氣密性;防止產物遇空氣再被氧化;a;7.2;91.2
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:70引用:1難度:0.4
相似題
-
1.歸納與總結是學習化學的重要方法。下列對所學知識的歸納與總結完全正確的是( )
A.物質分類 B.日常生活經驗 ①海水、碘酒--混合物
②氯化鈉、紅磷--化合物①使煤燃燒更旺--把煤作成蜂窩狀
②防止菜刀生銹--用濕布包起來C.安全常識 D.物質性質與用途 ①進入地窖--先做燈火試驗
②煤氣泄漏--立即關閉閥門并開窗通風①氧氣能助燃--作高能燃料
②氮氣化學性質穩定--充入食品包裝中防腐A.A B.B C.C D.D 發布:2025/1/8 8:0:1組卷:14引用:1難度:0.6 -
2.歸納與總結是學好化學的重要方法。下列認識中,完全正確的是( )
A.分類知識 B.安全常識 海水、碘酒--混合物
氧化鎂、四氧化三鐵--氧化物
氯化鈉、二氧化錳--化合物
銅、紅磷--單質煤氣泄漏--嚴禁火種
稀釋濃硫酸-水倒入濃硫酸中
溶洞探險-須做燈火實驗
減少酸雨的發生--使用新型能源C.影響因素 D、日常生活經驗 元素化學性質與最外層電子數有關
元素的種類由質子數決定
物質的結構決定物質的性質
化學反應速率與溫度、催化劑、反應物濃度、反應物間的接觸面積等因素有關食品干燥劑--常用CuO
區別硬水與軟水--常用肥皂水檢驗
使煤燃燒更旺--把煤作成蜂窩狀
防菜刀生銹--用濕布包起來A.A B.B C.C D.D 發布:2025/1/8 8:0:1組卷:4引用:1難度:0.6 -
3.鐵是一種重要的金屬。下列關于鐵的敘述錯誤的是( )
A.生鐵是純凈物 B.涂油漆可防止鐵生銹 C.工業上常用赤鐵礦煉鐵 D.鐵與硫酸銅溶液能發生反應 發布:2024/12/31 8:0:1組卷:28引用:1難度:0.7


