下面是某研究小組研究的關(guān)于不同催化劑對H2O2 分解反應(yīng)的催化效率.
| 催化劑(0.1g) | 活性炭 | FeCl3 | KI | MnO2顆粒狀 | MnO2粉末狀 |
| 前15s產(chǎn)生氧氣的量(ml) | 5 | 11 | 7 | 8 | 11 |
| 前30s產(chǎn)生氧氣的量(ml) | 8 | 16 | 11 | 11 | 21 |
| 前45s產(chǎn)生氧氣的量(ml) | 11 | 20 | 15 | 18 | 35 |
| 前60s產(chǎn)生氧氣的量(ml) | 15 | 24 | 20 | 26 | 49 |
2H2O2 2H2O+O2↑
催化劑
2H2O2 2H2O+O2↑
催化劑
(2)從上表可以得出:活性炭、FeCl3、KI 和MnO2(粉末狀)幾種催化劑中,催化效率由大到小的順序是
MnO2(粉末狀)>FeCl3>KI>活性炭
MnO2(粉末狀)>FeCl3>KI>活性炭
,等質(zhì)量的固體催化劑,顆粒大小對催化效率有什么影響顆粒越小催化效果越好
顆粒越小催化效果越好
(3)實驗發(fā)現(xiàn)新鮮的動物肝臟對H2O2 的分解也有顯著的催化作用,但當(dāng)往溶液中加入鹽酸,或給溶液加熱時,就會失去催化能力,合理的解釋是
催化劑失去活性
催化劑失去活性
(4)對于FeCl3的催化作用,有人認(rèn)為是Fe3+起催化作用,有人認(rèn)為是Cl-,請你設(shè)計一個實驗進(jìn)行驗證.
取少量H2O2分別滴加Fe2(SO4)3溶液、NaCl溶液,觀察H2O2的分解速率,若前者明顯加快后者不明顯,則證明Fe3+起催化作用,否則則證明起催化作用Cl-
取少量H2O2分別滴加Fe2(SO4)3溶液、NaCl溶液,觀察H2O2的分解速率,若前者明顯加快后者不明顯,則證明Fe3+起催化作用,否則則證明起催化作用Cl-
.【答案】2H2O2 2H2O+O2↑;MnO2(粉末狀)>FeCl3>KI>活性炭;顆粒越小催化效果越好;催化劑失去活性;取少量H2O2分別滴加Fe2(SO4)3溶液、NaCl溶液,觀察H2O2的分解速率,若前者明顯加快后者不明顯,則證明Fe3+起催化作用,否則則證明起催化作用Cl-
催化劑
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:204引用:3難度:0.1
相似題
-
1.鋰離子電池已經(jīng)成為新一代實用化的蓄電池,該電池具有能量密度大、電壓高的特性。
鋰離子電池放電時電極反應(yīng)式為負(fù)極:C6Li-xe-═C6Li1-x+xLi+(C6Li表示鋰原子嵌入石墨形成復(fù)合材料)正極:Li1-xMO2+xLi++xe-═LiMO2(LiMO2表示含鋰的過渡金屬氧化物)。
(1)鋰電池放電時電池的反應(yīng)式為。
(2)假設(shè)放電過程中消耗負(fù)極材料5.6g,轉(zhuǎn)移的電子數(shù)目為(NA為阿伏加德羅常數(shù)值)。
(3)已知破壞1molH-H鍵、1molO═O鍵、1molH-O鍵時分別需要吸收436kJ、498kJ、465kJ的能量。下圖表示H2、O2轉(zhuǎn)化為水的反應(yīng)過程能量變化,則b=。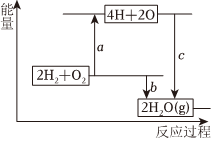
(4)某研究性學(xué)習(xí)小組為探究鋅與鹽酸反應(yīng),取同質(zhì)量、同體積的鋅片、同濃度鹽酸做了如下平行實驗:
實驗①:把純鋅片投入到盛有稀鹽酸的試管中,發(fā)現(xiàn)氫氣發(fā)生的速率變化如圖所示;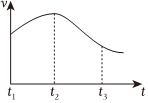
實驗②:把純鋅片投入到含F(xiàn)eCl3的同濃度工業(yè)稀鹽酸中,發(fā)現(xiàn)放出氫氣的量減少。
實驗③:在鹽酸中滴入幾滴CuCl2溶液,生成氫氣速率加快。
試回答下列問題:
①試分析實驗①中t1~t2速率增大的主要原因是。t2~t3速率減小的主要原因是。
②實驗②放出氫氣的量減少的原因是。
③某同學(xué)認(rèn)為實驗③反應(yīng)速率加快的主要原因是因為形成了原電池,你認(rèn)為是否正確?(填“正確”或“不正確”)。請選擇下列相應(yīng)的a或b作答。
a.若不正確,請說明原因。
b.若正確則寫出實驗③中原電池的正極電極反應(yīng)式:。發(fā)布:2024/6/27 10:35:59組卷:51引用:2難度:0.6 -
2.(1)對于Fe+2H+═Fe2++H2↑改變下列條件對反應(yīng)速率和產(chǎn)量有何影響 (填“增大”“減小”或“不變”):把鐵片改成鐵粉:
; 滴加幾滴濃硫酸; 加壓:;
(2)某小組利用H2C2O4溶液和硫酸酸化的KMnO4溶液反應(yīng)來探究“外界條件對化學(xué)反應(yīng)速率的影響”。實驗時通過測定酸性KMnO4溶液褪色所需時間來判斷反應(yīng)的快慢。該小組設(shè)計了如下方案。已知:
①表中V1=實驗
編號0.1mol/L酸性KMnO4溶液的體積/mL 0.6mol/LH2C2O4溶液的體積/mL H2O的體積/mL 實驗溫度/℃ 溶液褪色所需時間/min ① 10 V1 35 25 ② 10 10 30 25 ③ 10 10 V2 50 mL
②探究溫度對化學(xué)反應(yīng)速率影響的實驗編號是(填編號)
③實驗③測得KMnO4溶液的褪色時間為2min,忽略混合前后溶液體積的微小變化,這段時間內(nèi)平均反應(yīng)速率v(H2C2O4)=mol?L-1?min-1。發(fā)布:2024/6/27 10:35:59組卷:183引用:4難度:0.7 -
3.8.12天津港特大爆炸事故現(xiàn)場有700噸左右氰化鈉,氰化鈉劇毒.有少量因爆炸沖擊發(fā)生泄漏.這些泄漏的氰化鈉可通過噴灑氧化劑雙氧水的方式來處理,以減輕污染.
(1)寫出NaCN的電子式,偏堿性條件下,氰化鈉溶液的CN-被雙氧水氧化為HCO3-,同時放出NH3,該反應(yīng)的離子方程式:.
(2)Cu2+可作為雙氧水氧化CN-中的催化劑.某興趣小組要探究Cu2+對雙氧水氧化CN-是否起催化作用,請你完成下實驗方案.填寫實驗步驟、實驗現(xiàn)象和結(jié)論(已知:CN-濃度可用離子色譜儀測定)步驟:分別取等體積、等濃度的含氰廢水于甲、乙兩支試管中, 現(xiàn)象與結(jié)論:
若
若發(fā)布:2024/6/27 10:35:59組卷:51引用:3難度:0.5


