A、B、C、D、E、F均為周期表中前四周期的元素,且原子序數(shù)依次增大。請(qǐng)按要求回答下列問(wèn)題。
 ?
?
(1)A與氫元素形成的兩種化合物AH3、A2H4是弱堿,比較表中兩種化合物的熔沸點(diǎn),解釋其高低的主要原因 N2H4分子間形成的氫鍵數(shù)目多與NH3分子間形成的氫鍵數(shù)目N2H4分子間形成的氫鍵數(shù)目多與NH3分子間形成的氫鍵數(shù)目。
| A2H4 | AH3 | |
| 熔點(diǎn)/℃ | 2 | -77.8 |
| 沸點(diǎn)/℃ | 113.5 | -33.5 |
原子軌道
原子軌道
,電子除空間運(yùn)動(dòng)狀態(tài)外,還有一種運(yùn)動(dòng)狀態(tài)叫做 自旋
自旋
。B是地殼中含量最高的元素,B基態(tài)原子的電子空間運(yùn)動(dòng)狀態(tài)有 5
5
種。(3)已知C和D為第三周期元素,其原子的第一至第四電離能如表所示:
| 電離能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| C(或D) | 578 | 1817 | 2745 | 11578 |
| C(或D) | 738 | 1451 | 7733 | 10540 |
bd
bd
。a.離子半徑C<D
b.電負(fù)性C<D
c.單質(zhì)的熔點(diǎn)C>D
d.C、D的單質(zhì)均能與氧化物發(fā)生置換
e.C的氧化物具有兩性
f.C、D均能與氯元素構(gòu)成離子晶體
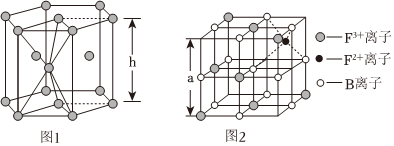
(4)E的晶胞是六方最密堆積結(jié)構(gòu)(如圖1),E原子的配位數(shù)為
12
12
;若E的相對(duì)原子質(zhì)量為M,E原子半徑為 rcm。該晶胞的空間利用率為 4
3
πr
9
h
4
3
πr
9
h
(5)F元素形成的常見離子有F2+、F3+,其中F3+中有5個(gè)單電子。圖2是從離子晶體F3B4取出的一個(gè)能體現(xiàn)其晶體結(jié)構(gòu)的立方體,則晶體中的B離子是否構(gòu)成了面心立方堆積
是
是
(填“是”或“否”),該立方體是不是F3B4的晶胞 否
否
(填“是”或“否”)。【答案】N2H4分子間形成的氫鍵數(shù)目多與NH3分子間形成的氫鍵數(shù)目;原子軌道;自旋;5;bd;12;×100%;是;否
4
3
πr
9
h
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/8/4 8:0:9組卷:71引用:1難度:0.5
相似題
-
1.X、Y、Z、M、N均為短周期主族元素,原子序數(shù)依次增大。X是宇宙中含量最高的元素,YX3分子呈三角錐形,Z的價(jià)電子排布式為nsnnpn+2,五種元素中M的電負(fù)性最小,N的最高價(jià)含氧酸酸性最強(qiáng)。下列說(shuō)法正確的是( )
A. 的VSEPR模型為V形YZ-2B.由X、Y、Z三種元素組成的化合物的水溶液均顯酸性 C.同周期中第一電離能大于Z的元素有3種 D.MN晶體中M離子的配位數(shù)為8 發(fā)布:2025/1/5 8:0:1組卷:47引用:1難度:0.5 -
2.A、B、C、D、E為原子序數(shù)依次增大的五種短周期元素;A是宇宙中最豐富的元素且與E同主族;B位于元素周期表ⅣA族;C在元素周期表中與B、D相鄰;D基態(tài)原子的s軌道與p軌道的電子總數(shù)相等且p軌道有2個(gè)未成對(duì)的電子;E是短周期中原子半徑最大的元素;F原子核外電子數(shù)為29.回答下列問(wèn)題:
(1)F基態(tài)原子的核外電子排布式為。
(2)A、B、C、D、E五種元素中,電負(fù)性最小的元素為(填元素符號(hào),下同),第一電離能最大的元素為;A3D+的立體構(gòu)型為。
(3)A、B可形成多種化合物,其中相對(duì)分子質(zhì)量為28的分子,其中心原子的雜化方式為,該分子中σ鍵和π鍵的數(shù)目之比為。
(4)化合物BD2和E2D2的晶體類型分別為、。
(5)F單質(zhì)為面心立方晶體,若F的相對(duì)原子質(zhì)量為M,阿伏加德羅常數(shù)為NA,晶胞邊長(zhǎng)為a cm,則晶體F的密度ρ=g?cm-3。發(fā)布:2025/1/18 8:0:1組卷:27引用:2難度:0.3 -
3.已知A、B、C、D、E、F、G都是短周期的元素,它們的原子序數(shù)依次遞增.A原子的電子層數(shù)與它的核外電子總數(shù)相同,而B原子的最外層電子數(shù)是次外層的2倍,C的氫化物可使?jié)駶?rùn)的紅色石蕊試紙變藍(lán),B和D可以形成兩種氣態(tài)化合物,E原子核外電子總數(shù)比B的2倍少1,D與F同主族,G的原子半徑是本周期元素中最小的.則:
(1)A元素為C元素為E元素為
(2)由上述元素形成的10電子分子有、.
(3)由B和D以質(zhì)量比為3:8組成的化合物與E的同周期相鄰主族元素的單質(zhì)反應(yīng)的化學(xué)方程式為.
(4)G單質(zhì)與E的最高價(jià)氧化物的水化物反應(yīng)的離子方程式為
(5)B、C、D形成的氣態(tài)氫化物中,較穩(wěn)定的是
(6)由A、C、G形成的離子化合物的化學(xué)式是.發(fā)布:2024/12/30 18:30:1組卷:7引用:3難度:0.5
相關(guān)試卷


