將H2S轉(zhuǎn)化為可再利用的資源是能源研究領(lǐng)域的重要課題。
(1)H2S的轉(zhuǎn)化
| Ⅰ | 克勞斯法 | H2S O 2 |
| Ⅱ | 鐵鹽氧化法 | H2S F e 3 + |
| Ⅲ | 光分解法 | H2S 光 某溶液 |
2H2S+O2=2H2O+2S
2H2S+O2=2H2O+2S
。②反應(yīng)Ⅱ:
2Fe3+
2Fe3+
+1H2S═2
2
Fe2++1
1
S↓+2H+
2H+
(將反應(yīng)補(bǔ)充完整)。③反應(yīng)Ⅲ體現(xiàn)了H2S的穩(wěn)定性弱于H2O.結(jié)合原子結(jié)構(gòu)解釋二者穩(wěn)定性差異的原因:
O與S位于同主族,原子半徑S>O,得電子能力S<O,非金屬性S<O,氫化物穩(wěn)定性H2S<H2O
O與S位于同主族,原子半徑S>O,得電子能力S<O,非金屬性S<O,氫化物穩(wěn)定性H2S<H2O
。(2)反應(yīng)Ⅲ硫的產(chǎn)率低,反應(yīng)Ⅱ的原子利用率低。我國科研人員設(shè)想將兩個反應(yīng)耦合,實(shí)現(xiàn)由H2S高效產(chǎn)生S和H2,電子轉(zhuǎn)移過程如圖。
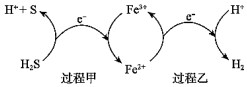
過程甲、乙中,氧化劑分別是
Fe3+、H+
Fe3+、H+
。(3)按照設(shè)計,科研人員研究如下。
①首先研究過程乙是否可行,裝置如圖。經(jīng)檢驗,n極區(qū)產(chǎn)生了Fe3+,p極產(chǎn)生了H2.n極區(qū)產(chǎn)生Fe3+的可能原因:
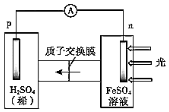
ⅰ.Fe2+-e-=Fe3+
ⅱ.2H2O-4e-=O2 +4H+,
4Fe2++O2+4H+=4Fe3++2H2O
4Fe2++O2+4H+=4Fe3++2H2O
(寫離子方程式)。經(jīng)確認(rèn),ⅰ是產(chǎn)生Fe3+的原因。過程乙可行。
②光照產(chǎn)生Fe3+后,向n極區(qū)注入H2S溶液,有S生成,持續(xù)產(chǎn)生電流,p極產(chǎn)生H2.研究S產(chǎn)生的原因,設(shè)計如下實(shí)驗方案:
將FeSO4溶液換為H2S溶液
將FeSO4溶液換為H2S溶液
。 經(jīng)確認(rèn),S是由Fe3+氧化H2S所得,H2S不能直接放電。過程甲可行。(4)綜上,反應(yīng)Ⅱ、Ⅲ能耦合,同時能高效產(chǎn)生H2和S,其工作原理如圖。
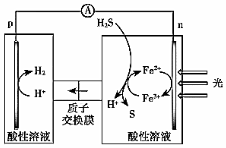
進(jìn)一步研究發(fā)現(xiàn),除了Fe3+/Fe2+外,I3-/I-也能實(shí)現(xiàn)如圖所示循環(huán)過程。結(jié)合化學(xué)用語,說明I3-/I-能夠使S源源不斷產(chǎn)生的原因:
I-在電極上放電3I--2e-=I3-,I3-在溶液中氧化H2S:I3-+H2S=3I-+S+2H+,I3-、I-循環(huán)反應(yīng)
I-在電極上放電3I--2e-=I3-,I3-在溶液中氧化H2S:I3-+H2S=3I-+S+2H+,I3-、I-循環(huán)反應(yīng)
。【考點(diǎn)】含硫物質(zhì)的性質(zhì)及綜合應(yīng)用;原電池與電解池的綜合.
【答案】2H2S+O2=2H2O+2S;2Fe3+;2;1;2H+;O與S位于同主族,原子半徑S>O,得電子能力S<O,非金屬性S<O,氫化物穩(wěn)定性H2S<H2O;Fe3+、H+;4Fe2++O2+4H+=4Fe3++2H2O;將FeSO4溶液換為H2S溶液;I-在電極上放電3I--2e-=I3-,I3-在溶液中氧化H2S:I3-+H2S=3I-+S+2H+,I3-、I-循環(huán)反應(yīng)
【解答】
【點(diǎn)評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:76引用:3難度:0.6
相似題
-
1.下列說法不正確的是( )
A.硫是一種淡黃色能溶于水的固體 B.硫的化合物常存在于火山噴出的氣體中和礦泉水里 C.硫是黑火藥的主要成分 D.一些動、植物體內(nèi)也含有硫元素 發(fā)布:2024/12/30 15:0:1組卷:11引用:2難度:0.8 -
 2.硫俗稱硫黃,主要存在于火山口附近或地殼的巖層中(如圖),是一種黃色晶體,質(zhì)脆易研成粉末,熔點(diǎn)為113℃,沸點(diǎn)為445℃,密度為2.06g/cm3。硫黃難溶于水,微溶于酒精、醚,易溶于二硫化碳。作為易燃固體,硫黃主要用于制造染料、農(nóng)藥、火柴、火藥等。硫黃雖然是低毒性物質(zhì),但其燃燒后的氣體對人體有致命的危害。
2.硫俗稱硫黃,主要存在于火山口附近或地殼的巖層中(如圖),是一種黃色晶體,質(zhì)脆易研成粉末,熔點(diǎn)為113℃,沸點(diǎn)為445℃,密度為2.06g/cm3。硫黃難溶于水,微溶于酒精、醚,易溶于二硫化碳。作為易燃固體,硫黃主要用于制造染料、農(nóng)藥、火柴、火藥等。硫黃雖然是低毒性物質(zhì),但其燃燒后的氣體對人體有致命的危害。
(1)指出硫元素在元素周期表中的位置,硫元素的最高正價與最低負(fù)價分別是多少。
(2)從硫元素價態(tài)變化的角度分析,單質(zhì)硫有哪些化學(xué)性質(zhì)。
(3)如何用化學(xué)方法清洗試管內(nèi)壁上附著的硫黃。寫出反應(yīng)的離子方程式。發(fā)布:2024/12/30 15:0:1組卷:6引用:2難度:0.7 -
3.下列說法正確的是( )
A.S在過量的O2中充分燃燒,可得SO3 B.單質(zhì)硫難溶于水,易溶于酒精和二硫化碳 C.鐵與過量單質(zhì)硫加熱時反應(yīng)生成Fe2S3 D.硫在O2中燃燒發(fā)出明亮的藍(lán)紫色火焰產(chǎn)生無色有刺激性氣味的氣體 發(fā)布:2024/12/30 15:0:1組卷:4引用:2難度:0.8
相關(guān)試卷


