氫化鈣(CaH2)是種白色細顆粒狀固體,能與水發生劇烈反應,其反應的化學方程式為:CaH2+2H2O=Ca(OH)2+2H2↑,常用作登山運動員的能源提供劑。某化學實驗小組為了探究氫化鈣的性質,將一定量的CaH2加入到碳酸鈉溶液中,立即產生大量氣泡,且溶液變渾濁。充分反應后過濾,得到濾渣和濾液,濾渣的主要成分是CaCO3CaCO3(填寫化學式)。
為進步確定濾液中所含溶質的成分,他們進行了以下實驗探究。
【提出猜想】猜想一:NaOH:猜想二:NaOH和Na2CO3;
猜想三:NaOH、Ca(OH)2NaOH、Ca(OH)2; 猜想四:NaOH、Na2CO3、Ca(OH)2
經過分析,大家一致認為上述猜想四四不需要驗證,肯定是錯誤的,原因是Na2CO3+Ca(OH)2═2NaOH+CaCO3↓Na2CO3+Ca(OH)2═2NaOH+CaCO3↓(用化學方程式表示)。
【實驗探究】
方案一:取一定量的濾液于試管中,往其中滴加少量稀鹽酸,無明顯實驗現象。
方案二:取一定量的濾液于另一試管中,往其中滴加氯化鋇溶液,觀察到有白色沉淀產生。
【討論交流】根據實驗現象,得出猜想二二是正確的。請解釋方案一中無明顯現象的原因是稀鹽酸的量很少,不足以或恰好和氫氧化鈉反應稀鹽酸的量很少,不足以或恰好和氫氧化鈉反應。
【拓展探究】上述小組同學將5g氫化鈣樣品(所含雜質不參與反應也不溶于水)加入到50g碳酸鈉溶液中,充分混合后,恰好完全反應。實驗測得反應過程中產生氣體的質量為0.4g。計算:
(1)樣品中CaH2的質量分數為84%84%。
(2)原碳酸鈉溶液中溶質的質量為10.6g10.6g。
(3)反應后溶液中溶質的質量分數為18.3%18.3%。(計算結果保留一位小數)
【考點】化學實驗方案的設計與評價;根據化學反應方程式的計算.
【答案】CaCO3;NaOH、Ca(OH)2;四;Na2CO3+Ca(OH)2═2NaOH+CaCO3↓;二;稀鹽酸的量很少,不足以或恰好和氫氧化鈉反應;84%;10.6g;18.3%
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:8引用:1難度:0.5
相似題
-
1.除去下列各組物質中的少量雜質,所用的試劑和方法正確的是( )
選項 物質 雜質 除雜質所用試劑和方法 A CO2 HCl 將混合氣體通過足量NaOH溶液、干燥 B CaCl2溶液 鹽酸 加入過量的碳酸鈣粉末,過濾 C NaOH溶液 Na2CO3溶液 加入適量的CaCl2溶液、過濾 D CuO Cu粉 加入適量的稀硫酸,過濾、洗滌 A.A B.B C.C D.D 發布:2024/12/28 15:30:1組卷:15引用:4難度:0.5 -
2.某科學興趣小組為了探究溴化氫的性質,做了如圖所示的實驗:
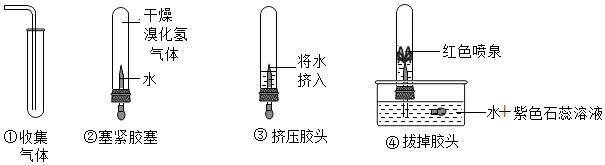
根據上述的操作和現象分析,下列說法正確的是( )A.若將紫色石蕊溶液改為酚酞溶液,可以看到藍色噴泉 B.溴化氫氣體的密度比空氣小 C.試管內液體的pH>7 D.溴化氫溶液能與氫氧化鈉溶液發生反應 發布:2024/12/28 13:30:2組卷:22引用:4難度:0.5 -
3.為除去下列物質中的雜質(括號內是雜質),下列操作方法正確的是( )
選項 物質 操作方法 A Fe(Fe2O3) 加入過量稀鹽酸,充分反應后過濾 B CaO粉末(CaCO3粉末) 加足量的水,充分攪拌后過濾 C NaOH溶液[Ca(OH)2溶液] 通入過量CO2氣體,充分反應后過濾 D CuSO4溶液(硫酸) 加入過量CuO粉末,充分反應后過濾 A.A B.B C.C D.D 發布:2024/12/28 15:0:1組卷:18引用:4難度:0.7


