當前位置:
試題詳情
下表為元素周期表中的一部分,用化學式或元素符號回答下列問題:
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
Ar
Ar
;(2)④②⑤中,最高價氧化物的水化物,堿性最強的堿是
KOH
KOH
;(3)②④⑦中形成的簡單離子,半徑由大到小的順序是
S2->K+>Ca2+
S2->K+>Ca2+
;(4)寫出①與⑦形成的最簡單化合物的電子式


(5)①和⑤最高價氧化物對應的水化物相互反應的化學方程式為
NaOH+Al(OH)3=Na[Al(OH)4]
NaOH+Al(OH)3=Na[Al(OH)4]
(6)試比較與⑦與⑧兩種元素最簡單氫化物的沸點高低
H2O>H2S
H2O>H2S
.(7)設計一個簡單實驗證明⑦⑨兩種元素非金屬性強弱的比較
把溴水加到Na2S(或氫硫酸)溶液中,出現淡黃色沉淀;從而證明Br的非金屬性強于S的
把溴水加到Na2S(或氫硫酸)溶液中,出現淡黃色沉淀;從而證明Br的非金屬性強于S的
.【答案】Ar;KOH;S2->K+>Ca2+; ;NaOH+Al(OH)3=Na[Al(OH)4];H2O>H2S;把溴水加到Na2S(或氫硫酸)溶液中,出現淡黃色沉淀;從而證明Br的非金屬性強于S的
;NaOH+Al(OH)3=Na[Al(OH)4];H2O>H2S;把溴水加到Na2S(或氫硫酸)溶液中,出現淡黃色沉淀;從而證明Br的非金屬性強于S的
 ;NaOH+Al(OH)3=Na[Al(OH)4];H2O>H2S;把溴水加到Na2S(或氫硫酸)溶液中,出現淡黃色沉淀;從而證明Br的非金屬性強于S的
;NaOH+Al(OH)3=Na[Al(OH)4];H2O>H2S;把溴水加到Na2S(或氫硫酸)溶液中,出現淡黃色沉淀;從而證明Br的非金屬性強于S的【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/11/14 8:0:1組卷:17引用:1難度:0.3
相似題
-
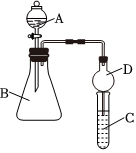 1.某同學為探究元素周期表中元素性質的遞變規律,設計了如下系列實驗.
1.某同學為探究元素周期表中元素性質的遞變規律,設計了如下系列實驗.
Ⅰ(1)將鈉、鉀、鎂、鋁各1mol分別投入到足量的同濃度的鹽酸中,試預測實驗結果:與鹽酸反應最劇烈,與鹽酸反應的速度最慢;與鹽酸反應產生的氣體最多.
(2)向Na2S溶液中通入氯氣出現黃色渾濁,可證明Cl的非金屬性比S強,反應的離子方程式為;
(3)將NaOH溶液與NH4Cl溶液混合生成NH3?H2O,從而驗證NaOH的堿性大于NH3?H2O,繼而可以驗證Na的金屬性大于N,你認為此設計是否合理?并說明理由:,.
Ⅱ.利用圖裝置可驗證同主族元素非金屬性的變化規律
(4)儀器B的名稱為,干燥管D的作用為.
(5)若要證明非金屬性:Cl>I,則A中加濃鹽酸,B中加KMnO4,(KMnO4與濃鹽酸常溫下反應生成氯氣),C中加淀粉碘化鉀混合溶液,觀察到C中溶液的現象,即可證明.從環境保護的觀點考慮,此裝置缺少尾氣處理裝置,可用溶液吸收尾氣.
(6)若要證明非金屬性:C>Si,則在A中加鹽酸、B中加CaCO3、C中加Na2SiO3溶液,觀察到C中溶液的現象,即可證明.但有的同學認為鹽酸具有揮發性,可進入C中干擾實驗,應在兩裝置間添加裝有溶液的洗氣瓶.發布:2024/6/27 10:35:59組卷:30引用:1難度:0.3 -
2.硅烷是指與烷烴結構類似,分子通式為SinH2n+2的一類化合物.其中一部分烷烴的物理性質如下表:
四種烷烴的物質性質
當n為1時稱為“甲硅烷”,甲硅烷能在空氣中自燃,生成無定形的二氧化硅,同時放出大量的熱.SiH4 Si2H6 Si3H8 Si4H10 熔點(℃) -185 -132.5 -117.4 -84.3 沸點(℃) -111.9 -14.5 52.9 107.4 熔點時密度(g/cm3) 0.68 0.69 0.725 0.79
SiH4+2O2SiO2+2H2O點燃
請完成下列填空:
(1)短周期元素中,原子序數小于硅的主族非金屬元素共有種.短周期元素中,最外層未對電子數與硅相同的元素是(填元素符號).與硅元素同主族的短周期元素A的氫化物與上述化學反應中兩種氫化物比較,穩定性由強到弱的順序是(用化學式表示).
(2)上表中硅烷熔沸點遞變規律是原因是.其中Si3H8的三氯代物分子中極性鍵與非極性鍵的個數比是.
(3)你認為甲硅烷燃燒時除了發光發熱,還可能有的實驗現象是.
(4)硅的最高價含氧酸鈉鹽溶于水,溶液顯性;相同條件下,該溶液與同主族、同濃度的短周期元素A的最高價含氧酸鈉鹽水溶液的pH(填化學式)溶液比溶液大.發布:2024/11/16 8:0:2組卷:38引用:1難度:0.5 -
3.某同學擬通過實驗探究同主族元素性質的遞變規律.設計的實驗方案如下,請你幫他填寫完整,并做出評價.
實驗室提供的試劑:NaBr溶液、NaI溶液、新制的氯水
(1)完善下列實驗報告中的實驗現象和實驗結論.
(2)該同學設計的實驗方案的合理性是實驗步驟 實驗現象 實驗結論 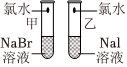
甲: .
乙:溶液由無色變為棕黃色結論:鹵素單質的氧化性由強到弱的順序為Cl2>Br2>I2,請從原子結構的角度解釋: .(填字母).
A.非常合理
B.部分合理
C.完全不合理
(3)上一題(2)中若選A,則此項不用再作答,若選B或C,則完成實驗還需要的試劑是,涉及的離子方程式為.發布:2024/6/27 10:35:59組卷:14引用:1難度:0.6


