科學興趣小組三位同學分別用相同質量分數的稀鹽酸,測定某石灰石樣品中碳酸鈣的質量分數(石灰石中的雜質既不與酸反應,也不溶于水)。
(1)小敏的方法可用如下流程表示,測得碳酸鈣的質量分數為 79%79%。

(2)小龍取10克樣品,用如圖甲實驗裝置進行實驗,反應結束后,測得B裝置增加的質量即為反應生成的二氧化碳的質量,從而算得碳酸鈣的質量分數,這樣算出的碳酸鈣的質量分數將 偏大偏大(選填“偏大”或“偏小”),造成這種情況的可能原因是 B中吸收二氧化碳中帶出的水蒸氣和氯化氫氣體B中吸收二氧化碳中帶出的水蒸氣和氯化氫氣體。
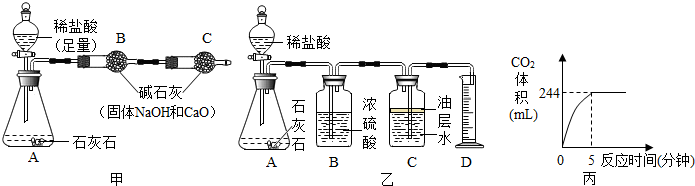
(3)小軍用如圖乙的實驗裝置進行實驗,將足量稀鹽酸加入到1.25克樣品中,生成的CO2體積與反應時間的關系如圖丙。已知本實驗條件下CO2的密度為1.8克/升,求生成的二氧化碳的質量(保留兩位小數)及石灰石樣品中CaCO3的質量分數。
【考點】根據化學反應方程式的計算.
【答案】79%;偏大;B中吸收二氧化碳中帶出的水蒸氣和氯化氫氣體
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/7/28 8:0:9組卷:85引用:2難度:0.5
相似題
-
 1.紹興盛產一種四角菱,稱“馱背白”。其菱肉富含淀粉等多種營養物質,此外菱角的莖和根富含纖維素(C6H10O5)n,也是一種很不錯的食物和藥材。
1.紹興盛產一種四角菱,稱“馱背白”。其菱肉富含淀粉等多種營養物質,此外菱角的莖和根富含纖維素(C6H10O5)n,也是一種很不錯的食物和藥材。
(1)菱肉中的鈣、磷、鐵等元素是以(填“單質”或“化合物”)的形態存在;
(2)該纖維素中C、H、O元素的質量比(最簡比);
(3)查閱資料獲悉菱肉制成的菱粉質細爽滑,為淀粉中之佳品。求菱葉產生3.6千克淀粉[有機物(CH2O)n]的同時,光合作用產生氧氣多少千克?(已知光合作用的化學方程式為:nCO2+nH2O═(CH2O)n+nO2,條件忽略)發布:2025/1/6 8:0:1組卷:4引用:1難度:0.5 -
2.小金為測定某樣品中氧化銅的質量分數,稱量固體樣品20.0克,用如圖所示的裝置進行實驗(雜質不參與反應且生成水完全被吸收),實驗中共消耗0.6克氫氣,測得B裝置反應前后的質量增加了3.6克。
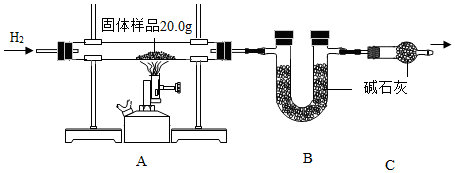
(1)C裝置的作用是;
(2)計算固體樣品中氧化銅的質量分數(根據化學方程式列式計算)。發布:2024/12/28 15:30:1組卷:12引用:2難度:0.5 -
3.侯德榜是我國著名的化學家,發明了侯氏制堿法,其反應原理如下:NaCl+CO2+NH3+H2O═NaHCO3+NH4Cl,請回答:
(1)反應產物中NH4C1可以用于農業生產,它屬于化肥中的肥。
(2)生產16.8t碳酸氫鈉,理論上需要氯化鈉的質量是多少?發布:2024/12/28 15:30:1組卷:12引用:2難度:0.5


