 (1)第三周期元素中,化學性質最不活潑的是ArAr,可用于制半導體材料的元 素是SiSi,最高價氧化物的水化物堿性最強的是NaOHNaOH,酸性最強的是HClO4HClO4,呈兩性的是Al(OH)3Al(OH)3。(用元素符號填空)
(1)第三周期元素中,化學性質最不活潑的是ArAr,可用于制半導體材料的元 素是SiSi,最高價氧化物的水化物堿性最強的是NaOHNaOH,酸性最強的是HClO4HClO4,呈兩性的是Al(OH)3Al(OH)3。(用元素符號填空)
(2)在 C、N、O、F 中,原子半徑最大的是CC。
(3)第 32 號元素在元素周期表中的位置為第四周期IVA族第四周期IVA族。
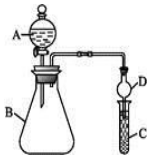
(4)利用如圖裝置可驗證同主族元素非金屬性的變化規律。
①儀器 A 的名稱為分液漏斗分液漏斗,干燥管 D 的作用為防止倒吸防止倒吸。
②若要證明非金屬性:Cl>I,則 A 中加濃鹽酸,B 中加 KMnO4,KMnO4 與濃鹽酸常溫下反應生成氯氣,C 中加淀粉-碘化鉀混合溶液,觀察到 C 中溶液變藍變藍(填現象),即可證明,氯氣在 C 中反應的離 子方程式為Cl2+2I-=2Cl-+I2Cl2+2I-=2Cl-+I2。從環境保護的觀點考慮,此裝置缺少尾氣處理裝置,可用NaOHNaOH溶液吸收尾氣,反應的化學方程式為Cl2+2NaOH=NaCl+NaClO+H2OCl2+2NaOH=NaCl+NaClO+H2O。
【答案】Ar;Si;NaOH;HClO4;Al(OH)3;C;第四周期IVA族;分液漏斗;防止倒吸;變藍;Cl2+2I-=2Cl-+I2;NaOH;Cl2+2NaOH=NaCl+NaClO+H2O
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:272引用:3難度:0.7
相似題
-
1.下列各組元素性質的遞變情況錯誤的是( )
A.N、O、F電負性依次增大 B.P、S、Cl元素最高正價依次升高 C.Na、Mg、Al第一電離能依次增大 D.Na、K、Rb電負性依次減小 發布:2024/12/30 16:0:2組卷:10引用:2難度:0.7 -
2.在解釋下列物質的變化規律與物質結構間的因果關系時,與化學鍵的強弱無關的是( )
A.鈉、鎂、鋁的熔點和沸點逐漸升高,硬度逐漸增大 B.金剛石的硬度大于晶體硅的硬度,其熔點也高于晶體硅的熔點 C.KF、KCl、KBr、KI的熔點依次降低 D.CF4、SiF4、GeF4、SnF4的熔點和沸點逐漸升高 發布:2024/12/30 15:0:1組卷:120引用:6難度:0.9 -
 3.如圖是第二周期主族元素的某些性質隨原子序數變化的柱形圖,則y軸可表示( )
3.如圖是第二周期主族元素的某些性質隨原子序數變化的柱形圖,則y軸可表示( )
①第一電離能
②電負性
③原子半徑
④簡單離子半徑
⑤最高正化合價
⑥形成簡單離子轉移的電子數A.② B.①② C.⑤ D.②⑤ 發布:2024/12/30 15:30:1組卷:85引用:3難度:0.7


