某化學興趣小組開展“測定密閉容器中氧氣的體積分數”的實驗探究。
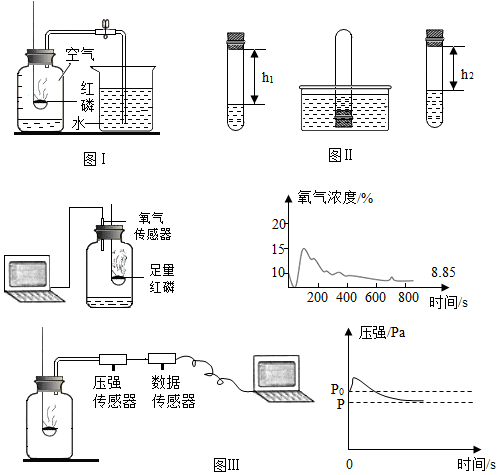
(1)圖Ⅰ為書本中測定空氣中氧氣含量的實驗。
①紅磷燃燒的符號表達式為 P+O2點燃P2O5P+O2點燃P2O5,該反應屬于的基本反應類型是 化合反應化合反應;
②若實驗過程中,沒有降到室溫就打開彈簧夾,則最終測得數據會 偏小偏小(填“偏大”或“偏小”或“無影響”)。
(2)小組成員通過查閱資料對書本實驗進行改進,利用四硫化鈉(Na2S4)固體可替代紅磷進行實驗,其反應原理為:Na2S4+O2+H2O→S+NaOH(S和NaOH均為固體,對實驗結果無影響),實驗設計如圖Ⅱ。實驗步驟如下:
a.取足量的四硫化鈉(Na2S4)固體置于試管中,加入適量的水,并迅速塞緊橡膠塞,再充分振蕩;
b.測量液面至橡膠塞下沿的距離,記錄數據h1;
c.將該試管插入水中,取下橡膠塞,觀察到試管內液面上升;
d.當管內液面穩定時塞緊橡膠塞.將試管取出倒轉過來,測量液面至橡膠塞下沿的距離記錄數據h2。
①步驟a中進行充分振蕩的目的是 增大四硫化鈉與氧氣、水的接觸面積,使反應充分增大四硫化鈉與氧氣、水的接觸面積,使反應充分;
②空氣中氧氣的體積分數約為 h1-h2h1×100%h1-h2h1×100%(用含h1和h2的公式表示)。
(3)圖Ⅲ實驗中,小組成員利用傳感器記錄紅磷燃燒時集氣瓶內氧氣濃度隨時間變化的情況以及集氣瓶內氣體壓強隨時間變化的情況(已知實驗過程中紅磷量充足)。
①從以上數據分析,最終集氣瓶中的氧氣沒有消耗完的依據是 反應結束后集氣瓶內的氧氣濃度不為零反應結束后集氣瓶內的氧氣濃度不為零;
②若該裝置氣密性良好,P0是集氣瓶內初始氣壓,P是反應結束后恢復到室溫時集氣瓶內的氣壓。則集氣瓶內壓強先變大的原因是 紅磷燃燒放熱,集氣瓶內氣體受熱膨脹,導致集氣瓶內壓強變大紅磷燃燒放熱,集氣瓶內氣體受熱膨脹,導致集氣瓶內壓強變大。
點燃
點燃
h
1
-
h
2
h
1
×
100
%
h
1
-
h
2
h
1
×
100
%
【考點】測定空氣里氧氣含量的探究.
【答案】P+O2P2O5;化合反應;偏小;增大四硫化鈉與氧氣、水的接觸面積,使反應充分;;反應結束后集氣瓶內的氧氣濃度不為零;紅磷燃燒放熱,集氣瓶內氣體受熱膨脹,導致集氣瓶內壓強變大
點燃
h
1
-
h
2
h
1
×
100
%
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:17引用:1難度:0.5
相似題
-
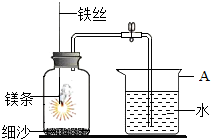 1.某校研究性學習小組用如圖所示裝置進行鎂條在空氣中燃燒的實驗。待鎂條完全燃燒并冷卻后打開彈簧夾,進入集氣瓶中水的體積約占集氣瓶容積的70%。
1.某校研究性學習小組用如圖所示裝置進行鎂條在空氣中燃燒的實驗。待鎂條完全燃燒并冷卻后打開彈簧夾,進入集氣瓶中水的體積約占集氣瓶容積的70%。
(1)圖中A儀器的名稱是。鎂條燃燒并冷卻后打開彈簧夾,水能進入到集氣瓶中的原因是。
(2)如果鎂條只和空氣中的氧氣反應,則進入集氣瓶中水的體積最多不超過其容積的%.現進入集氣瓶中水的體積約為其容積的70%,根據空氣的組成可推出減少的氣體中有氮氣。
【發現問題】氮氣是如何減少的?
【做出猜想】。
【查閱資料】鎂條在氮氣中能燃燒,產物為氮化鎂(Mg3N2)固體。氮化化鎂中氮的化合價是。鎂條還可以在二氧化碳氣體中燃燒生成碳和氧化鎂,反應的化學方程式為2Mg+CO2C+2MgO,該反應所的基本反應類型是點燃。
(3)通過以上探究,你對燃燒的有關知識有了哪些新的認識?(寫出一條即可)
(4)24g鎂在二氧化碳中燃燒可生成多少克氧化鎂?發布:2024/11/18 8:0:1組卷:13引用:1難度:0.5 -
2.如圖1是某化學興趣小組利用氣壓傳感器測定紅磷燃燒時集氣瓶內氣壓變化的實驗裝置。圖2是集氣瓶內氣壓隨時間的變化情況。下列說法不正確的是( )
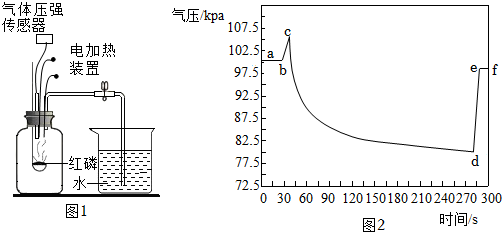
A.bc段氣壓增大的主要原因是紅磷燃燒放熱 B.cd段氣壓減小的主要原因是集氣瓶內氧氣不斷被消耗 C.紅磷熄滅后,若立即打開止水夾會導致測得的結果小于 15D.若用木炭代替紅磷,集氣瓶內氣壓變化趨勢與圖2基本一致 發布:2024/12/25 11:30:2組卷:1086引用:3難度:0.7 -
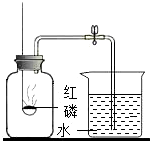 3.測定空氣里氧氣的含量,甲、乙、丙三個同學用如圖所示的裝置分別進行了實驗探究。
3.測定空氣里氧氣的含量,甲、乙、丙三個同學用如圖所示的裝置分別進行了實驗探究。
(1)實驗時,取下橡膠塞,點燃紅磷后迅速伸入集氣瓶中并旋緊橡膠塞,這時看到的現象是,該反應的文字表達式為。
(2)甲同學:用足量的木炭代替紅磷做測定空氣中氧氣含量的實驗,結果實驗失敗了,請你幫助他分析失敗的原因:。
(3)乙同學:想用鎂條來代替紅磷做實驗,老師告訴他這種方法不是較好的方法,因為鎂條在空氣中燃燒非常劇烈,鎂既可以和氧氣反應,也可以和氮氣反應生成氮化鎂。請寫出鎂和氮氣反應生成氮化鎂的文字表達式:。
(4)丙同學:打算用鐵絲替代紅磷,實驗能否成功?請說明理由。。
(5)燃燒后,集氣瓶內剩余的氣體主要是氮氣,請結合本實驗推測氮氣的物理性質是。發布:2024/11/7 8:0:2組卷:19引用:1難度:0.5


