目前,世界上多采用電解熔融氯化鈉的方法來生產金屬鈉:2NaCl(熔融) 通電 2Na+Cl2↑。已知A、B、C、D、E、F有如圖轉化關系:

(1)寫出A、B生成NaCl的化學方程式:2Na+Cl2 △ 2NaCl2Na+Cl2 △ 2NaCl。
(2)C與D反應的基本反應類型是 復分解反應復分解反應。
(3)寫出化學式:E Na2CO3Na2CO3,F CaCl2CaCl2。
(4)工業生產中常利用B與Ca(OH)2反應來制備漂白粉,漂白粉的主要成分是 CaCl2、Ca(ClO)2CaCl2、Ca(ClO)2(寫化學式)。
(5)若把A投入盛有D的溶液中,溶液中出現 紅褐色紅褐色(填沉淀顏色)沉淀,該過程所發生反應的化學方程式為 2Na+2H2O=2NaOH+H2↑、3NaOH+FeCl3=Fe(OH)3↓+3NaCl2Na+2H2O=2NaOH+H2↑、3NaOH+FeCl3=Fe(OH)3↓+3NaCl。
通電
△
△
【答案】2Na+Cl2 2NaCl;復分解反應;Na2CO3;CaCl2;CaCl2、Ca(ClO)2;紅褐色;2Na+2H2O=2NaOH+H2↑、3NaOH+FeCl3=Fe(OH)3↓+3NaCl
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/9/21 1:0:8組卷:0引用:1難度:0.6
相似題
-
1.如圖是部分短周期元素的單質及其化合物(或其溶液)的轉化關系,已知B、C、D、E是非金屬單質,且在常溫常壓下都是氣體;化合物G的焰色反應為黃色,化合物I和J通常狀況下呈氣態;
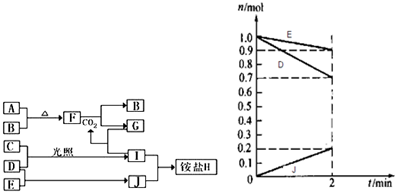
請完成下列填空:
(1)H的化學式;其晶體中所含化學鍵類型為;檢驗H 中陽離子的方法是.
(2)A與B 在加熱條件下反應的主要現象是;F和H2O反應的化學方程式為;寫出G溶液中加入過量的I溶液反應的離子方程式.
(3)某溫度時,在2L容器中,D、E、J三種物質的物質的量隨時間變化的曲線如圖所示.由圖中數據分析:該反應的化學方程式為.反應開始至2min,用J表示的平均反應速率為.發布:2024/12/30 15:0:1組卷:6引用:3難度:0.3 -
2.已知某物質X 能發生如下轉化:X
YO2①ZO2②A。下列有關上述轉化關系中物質及其反應的敘述錯誤的是( )H2O③A.若X為NH3,則A為硝酸 B.若X為H2S,則A為亞硫酸或者硫酸 C.反應①和②一定為氧化還原反應,反應③有可能為非氧化還原反應 D.若X為非金屬單質或非金屬氫化物,則A 一定能與金屬銅反應生成Y 發布:2025/1/6 6:0:5組卷:28引用:2難度:0.5 -
3.通常情況下,微粒A和B為分子,C和E為陽離子,D為陰離子,它們都含有10個電子;B溶于A后所得的物質可電離出C和D;A、B、E三種微粒反應后可得C和一種白色沉淀.請回答.
(1)用化學符號表示下列微粒:C:,D:.
(2)寫出A、B、E三種微粒反應的離子方程式:.發布:2024/12/30 17:0:2組卷:48引用:19難度:0.5


