實驗小組探究某補鐵口服液中鐵元素的價態。
【查閱資料】
KSCN中的硫元素為-2價。
【實驗過程】
| 編號 | 實驗操作 | 實驗現象 |
| 實 驗 Ⅰ |

|
無明顯變化 |
| 實 驗 Ⅱ |

|
溶液變紅 |
(1)由實驗Ⅰ可得出的結論是
補鐵劑口服液中不含Fe3+
補鐵劑口服液中不含Fe3+
。(2)根據實驗Ⅱ中的現象,可以斷定該補鐵口服液中鐵元素的價態為+2價,滴加H2O2溶液后Fe2+發生反應的離子方程式為
2Fe2++H2O2+2H+═2Fe3++2H2O
2Fe2++H2O2+2H+═2Fe3++2H2O
。(3)一段時間后,發現實驗II中溶液紅色褪去,可能的原因是
SCN-[KSCN、Fe(SCN)3]中的硫元素為-2價,具有強還原性,能被H2O2氧化
SCN-[KSCN、Fe(SCN)3]中的硫元素為-2價,具有強還原性,能被H2O2氧化
;小組同學為證實自己的猜想,設計如下對照實驗:向1mL 0.1mol?L-1 KSCN溶液中加入足量5%H2O2溶液,再加入BaCl2溶液,觀察到 產生白色沉淀
產生白色沉淀
,證實了小組同學的猜想是正確的。【答案】補鐵劑口服液中不含Fe3+;2Fe2++H2O2+2H+═2Fe3++2H2O;SCN-[KSCN、Fe(SCN)3]中的硫元素為-2價,具有強還原性,能被H2O2氧化;產生白色沉淀
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:153引用:1難度:0.5
相似題
-
1.將下列四種鐵的化合物溶于稀鹽酸,滴加KSCN溶液沒有顏色變化,再加入氯水即可顯血紅色的是( )
A.FeO B.Fe2O3 C.FeCl3 D.Fe(OH)3 發布:2024/11/19 8:0:22組卷:190引用:10難度:0.7 -
2.為探究鐵和稀硝酸反應后溶液中鐵元素存在形式,某化學實驗興趣小組設計實驗如下:
提出假設:
假設1:溶液中只有Fe2+;
假設2:;
假設3:.
設計實驗方案、驗證假設:(請完成下列表格)
問題分析:實驗操作 預期現象與結論 1. 若溶液不變紅,則假設1正確;
若溶液變紅,則假設2或假設3正確2.另取少許反應后溶液于試管中,滴加1-2滴0.01mol/L KMnO4溶液,振蕩
(1)若已知鐵和稀硝酸反應生成標準狀況下NO氣體2.24L,則上述反應中參加反應的硝酸物質的量為;
(2)若假設1正確,請寫出鐵和稀硝酸發生該反應的離子方程式:;
(3)某同學向反應后溶液中滴加適量NaOH溶液,未發現白色沉淀產生,由此斷定溶液中沒有Fe2+,他這種說法對嗎?請分析理由:.發布:2024/11/4 8:0:2組卷:34引用:1難度:0.5 -
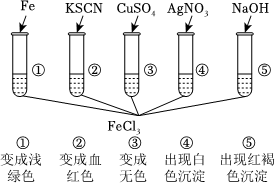 3.為了驗證Fe3+的性質,某化學興趣小組設計了如圖所示的實驗,實驗設計錯誤的是( )
3.為了驗證Fe3+的性質,某化學興趣小組設計了如圖所示的實驗,實驗設計錯誤的是( )A.①③④ B.③ C.③④ D.②④⑤ 發布:2024/12/16 6:0:1組卷:55引用:2難度:0.7


