中和反應是化學核心概念之一。某化學興趣小組欲對“NaOH溶液與稀鹽酸是否會發生反應”進行探究,設計并完成了如下實驗:
【實驗步驟】
步驟一:取一定量稀氫氧化鈉溶液于燒杯中,滴加2滴酚酞溶液,溶液呈紅色,如圖1所示。

步驟二:用滴管吸取稀鹽酸向燒杯中逐滴加入,邊滴加邊用玻璃棒攪拌,紅色剛剛褪去,停止滴加。
步驟三:取適量燒杯中的無色溶液,加熱蒸發得到白色固體。
【實驗分析】
(1)實驗中酚酞溶液的作用是 便于觀察反應的進程或通過酚酞試劑顏色的變化可以指示中和反應的發生便于觀察反應的進程或通過酚酞試劑顏色的變化可以指示中和反應的發生,小明認為實驗過程中不宜用紫色石蕊溶液代替酚酞溶液,可能原因是 石蕊溶液在堿性溶液中呈藍色,在中性溶液中呈紫色,顏色變化不明顯石蕊溶液在堿性溶液中呈藍色,在中性溶液中呈紫色,顏色變化不明顯。
(2)興趣小組中有同學認為也可能是滴入的稀鹽酸將溶液中的酚酞反應掉,于是他們又取燒杯中的無色溶液,滴加 氫氧化鈉溶液,溶液又變紅色氫氧化鈉溶液,溶液又變紅色,消除了該同學的疑惑。
(3)為確認步驟三中的白色固體是氯化鈉而不是氫氧化鈉,進行如下實驗:
| 步驟 | 現象 | 結論 | |
| 將白色固體溶于水形成溶液,均分成兩等份 | 向其中一份滴加 CuCl2(CuSO4、Cu(NO3)2等易溶于水的銅鹽都可以) CuCl2(CuSO4、Cu(NO3)2等易溶于水的銅鹽都可以) 溶液,振蕩、靜置 |
無藍色沉淀生成 | 白色固體不是NaOH |
| 向另一份滴加AgNO3溶液,振蕩、靜置 | 出現白色沉淀 | 白色固體是NaCl | |
NaOH+HCl=NaCl+H2O
NaOH+HCl=NaCl+H2O
。(4)電導率是衡量溶液導電能力大小的物理量,在相同條件下,電導率與離子濃度(單位體積內的離子數)成正比,興趣小組用電導率傳感器測氫氧化鈉溶液中滴加稀鹽酸的電導率變化(如圖2)

【分析與討論】
①OM段曲線下降的原因是
氫氧化鈉溶液與鹽酸反應的過程中氫氧根離子和氫離子結合生成水分子,在向氫氧化鈉溶液中滴加稀鹽酸的過程中,由于每反應1個OH-就會有1個C1-增加,因此離子數目不變,但溶液體積增大,使得溶液中離子的濃度降低,所以溶液電導率降低,曲線下降(合理即可)
氫氧化鈉溶液與鹽酸反應的過程中氫氧根離子和氫離子結合生成水分子,在向氫氧化鈉溶液中滴加稀鹽酸的過程中,由于每反應1個OH-就會有1個C1-增加,因此離子數目不變,但溶液體積增大,使得溶液中離子的濃度降低,所以溶液電導率降低,曲線下降(合理即可)
。②上述圖2中的反應在
M
M
點停止。③N點時溶液中的離子數
大于
大于
(填“小于”、“等于”或“大于”)P點時溶液中的離子數。【考點】中和反應及其應用.
【答案】便于觀察反應的進程或通過酚酞試劑顏色的變化可以指示中和反應的發生;石蕊溶液在堿性溶液中呈藍色,在中性溶液中呈紫色,顏色變化不明顯;氫氧化鈉溶液,溶液又變紅色;CuCl2(CuSO4、Cu(NO3)2等易溶于水的銅鹽都可以);NaOH+HCl=NaCl+H2O;氫氧化鈉溶液與鹽酸反應的過程中氫氧根離子和氫離子結合生成水分子,在向氫氧化鈉溶液中滴加稀鹽酸的過程中,由于每反應1個OH-就會有1個C1-增加,因此離子數目不變,但溶液體積增大,使得溶液中離子的濃度降低,所以溶液電導率降低,曲線下降(合理即可);M;大于
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:55引用:3難度:0.5
相似題
-
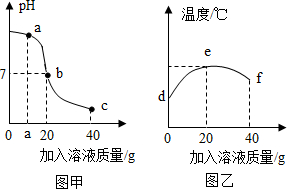 1.某校化學小組在利用鹽酸和氫氧化鈉溶液探究酸堿中和反應時,利用數字化傳感器測得燒杯中溶液pH的變化圖像如圖甲所示,溶液的溫度變化如圖乙所示(不考慮反應過程中熱量損失)。下列說法錯誤的是( )
1.某校化學小組在利用鹽酸和氫氧化鈉溶液探究酸堿中和反應時,利用數字化傳感器測得燒杯中溶液pH的變化圖像如圖甲所示,溶液的溫度變化如圖乙所示(不考慮反應過程中熱量損失)。下列說法錯誤的是( )A.當加入20g氫氧化鈉溶液時恰好完全反應 B.a點時溶液中的溶質為氫氧化鈉和氯化鈉 C.溫度上升是由于中和反應放熱,溫度下降是因為增加液體 D.e點時溶液中的溶質為氯化鈉 發布:2024/12/25 17:0:2組卷:70引用:3難度:0.6 -
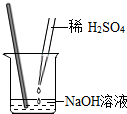 2.小明同學用如圖所示的方法做酸堿中和實驗,采用酚酞試液作指示劑,恰好完全中和時溶液的顏色為( )
2.小明同學用如圖所示的方法做酸堿中和實驗,采用酚酞試液作指示劑,恰好完全中和時溶液的顏色為( )A.無色 B.紅色 C.紫色 D.藍色 發布:2024/12/25 17:0:2組卷:68引用:3難度:0.9 -
3.某研究性學習小組為了探究氫氧化鈉溶液與稀硫酸是否恰好完全反應,分別取少量反應后的溶液于試管中,用下表中的不同試劑進行實驗.下列選項正確的是( )
選項 所用試劑 現象和結論 A 硫酸銅溶液 出現藍色沉淀,則氫氧化鈉過量 B 氯化鋇溶液 出現白色沉淀,則硫酸過量 C 銅絲 有氣泡產生,則硫酸過量 D 無色酚酞溶液 溶液不變色,則恰好完全反應 A.A B.B C.C D.D 發布:2024/12/25 17:30:2組卷:46引用:2難度:0.7


