醋酸溶液與氨水溶液都是高中化學中常見的電解質溶液。
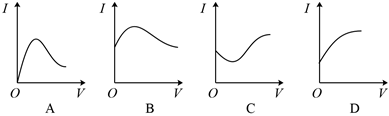
(1)向0.1mol/L的醋酸溶液中逐滴加入氨水至過量時,溶液的導電能力將發生相應的變化,其電流強度(I)隨加入氨水的體積(V)變化的曲線關系是圖中的 BB。
(2)往醋酸鈉溶液中滴加幾滴酚酞試液,然后將溶液加熱片刻,整個過程中可觀察到 溶液由無色變粉紅,加熱后紅色變深溶液由無色變粉紅,加熱后紅色變深,產生該現象的原因是 CH3COO-+H2O?CH3COOH+OH-水解產生OH-溶液變紅,水解吸熱,溫度升高,平衡正向移動,c(OH-)增大,紅色變深CH3COO-+H2O?CH3COOH+OH-水解產生OH-溶液變紅,水解吸熱,溫度升高,平衡正向移動,c(OH-)增大,紅色變深(用必要的文字和離子方程式加以解釋)。
(3)現有常溫下濃度均為0.1mol/L的3種溶液:①HCl;②氨水;③NH4Cl。
a.上述三種溶液的pH值由小到大的順序是 ①③②①③②(用編號表示)。
b.上述三種溶液中水的電離程度由大到小的順序是 ③②①③②①(用編號表示)。
c.將①②混合后,溶液中的c(NH4+)=c(Cl-),則鹽酸的體積 <<氨水的體積(填“>”、“<”或“=”)。
(4)下列有關(NH4)2SO4溶液的說法正確的是 ADAD。
A.電離方程式:(NH4)2SO4═2NH4++SO42-
B.水解離子方程式:NH4++H2O═NH3?H2O+H+
C.離子濃度關系:c(NH4+)+c(H+)=c(SO42-)+c(OH-)
D.微粒濃度大小:c(NH4+)>c(SO42-)>c(H+)>c(NH3?H2O)>c(OH-)
【答案】B;溶液由無色變粉紅,加熱后紅色變深;CH3COO-+H2O?CH3COOH+OH-水解產生OH-溶液變紅,水解吸熱,溫度升高,平衡正向移動,c(OH-)增大,紅色變深;①③②;③②①;<;AD
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:33引用:3難度:0.6
相似題
-
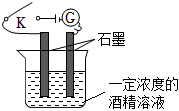 1.某學生利用如圖所示裝置對電解質溶液導電性進行實驗探究。下列說法中正確的是( )
1.某學生利用如圖所示裝置對電解質溶液導電性進行實驗探究。下列說法中正確的是( )A.閉合開關K后,電流計指針不發生偏轉,證明酒精溶液是非電解質 B.閉合開關K,往溶液中通入氯氣,隨著氣體通入,電流計示數增大,故氯氣是電解質 C.取用同濃度的蔗糖溶液替換酒精溶液,電流計的示數相同 D.閉合開關K,往燒杯中加NaCl固體,雖然固體溶解,由于不反應,故電流計指針不發生偏轉 發布:2024/12/21 8:0:2組卷:58引用:1難度:0.7 -
2.下列物質在熔融狀態下不導電的是( )
A.NaOH B.CaO C.HCl D.K2SO4 發布:2024/12/30 19:30:2組卷:33引用:4難度:0.8 -
3.下列各種物質導電性最差的是( )
A.稀硫酸 B.澄清的石灰水 C.鐵絲 D.固體食鹽 發布:2025/1/6 6:0:5組卷:7引用:3難度:0.9


