(1)可逆反應FeO(s)+CO(g)?Fe(s)+CO2(g)是煉鐵工業中一個重要反應,其溫度與平衡常數K的關系如表:
| T/K | 938 | 1100 |
| K | 0.68 | 0.40 |
K=
c
(
CO
2
)
c
(
CO
)
K=
。c
(
CO
2
)
c
(
CO
)
②若該反應在體積固定的密閉容器中進行,在一定條件下達到平衡狀態,若升高溫度,混合氣體的平均相對分子質量
減小
減小
;充入氦氣,混合氣體的密度增大
增大
。(填“增大”、“減小”或“不變”)(2)常溫下,濃度均為0.1mol?L-1的下列六種溶液的pH如表:
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
D
D
。(填編號)A.HCNB.HClO
C.H2CO3
D.CH3COOH
②據上表數據,請你判斷下列反應不能成立的是
C
C
。(填編號)A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
(3)泡沫滅火劑中裝有Al2(SO4)3溶液、NaHCO3溶液及起泡劑,寫出使用時發生反應的離子方程式
Al3++3═Al(OH)3↓+3CO2↑
HCO
-
3
Al3++3═Al(OH)3↓+3CO2↑
。HCO
-
3
(4)寫出難溶電解質的溶度積表達式,Mg(OH)2:
Ksp=c(Mg2+)?c2(OH-)
Ksp=c(Mg2+)?c2(OH-)
;在Mg(OH)2懸濁液中加入MgCl2固體,平衡逆向
逆向
移動(填“正向”、“逆向”或“不”),Ksp不變
不變
。(填“增大”“減小”或“不變”)(5)1g固體炭與水蒸氣反應生成CO氣體和H2氣體,需吸收akJ熱量,此反應的熱化學方程式為
C(s)+H2O(g)=CO(g)+H2(g)△=+12akJ?mol-1
C(s)+H2O(g)=CO(g)+H2(g)△=+12akJ?mol-1
。【答案】K=;減小;增大;D;C;Al3++3═Al(OH)3↓+3CO2↑;Ksp=c(Mg2+)?c2(OH-);逆向;不變;C(s)+H2O(g)=CO(g)+H2(g)△=+12akJ?mol-1
c
(
CO
2
)
c
(
CO
)
HCO
-
3
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:294引用:2難度:0.6
相似題
-
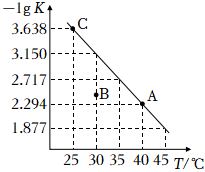 1.將一定量純凈的氨基甲酸銨固體置于密閉容器中,發生反應:NH2COONH4(s)?2NH3(g)+CO2(g)。該反應的平衡常數的負對數(-lgK)隨溫度(T)的變化如圖所示,下列說法不正確的是( )
1.將一定量純凈的氨基甲酸銨固體置于密閉容器中,發生反應:NH2COONH4(s)?2NH3(g)+CO2(g)。該反應的平衡常數的負對數(-lgK)隨溫度(T)的變化如圖所示,下列說法不正確的是( )A.該反應的ΔH>0 B.A點對應狀態的平衡常數K(A)的值為10-2.294 C.混合氣體的平均摩爾質量不變時,可以判斷該反應已達到平衡狀態 D.30℃時,B點對應狀態的v(正)<v(逆) 發布:2024/12/19 1:30:1組卷:135引用:4難度:0.7 -
2.已知:NO和O2轉化為NO2的反應機理如下:
①2NO(g)?N2O2(g)(快) ΔH1<0 平衡常數K1
②N2O2(g)+O2(g)?2NO2(g)(僈) ΔH2<0 平衡常數K2
下列說法正確的是( )A.2NO(g)+O2(g)?2NO2(g)的ΔH=-(ΔH1+ΔH2) B.②的速率大小決定2NO(g)+O2(g)?2NO2(g)的反應速率 C. 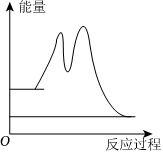
反應過程中的能量變化可用圖表示D.2NO(g)+O2(g)?2NO2(g)的平衡常數K= K1K2發布:2024/10/31 4:30:1組卷:55引用:3難度:0.8 -
3.Ⅰ.某溫度下,在一個容積可變的密閉容器中,反應2A(g)+B(g)?2C(g)達到平衡時,A、B、C的物質的量分別為4mol、2mol和4mol,此時容器容積為4L.則此溫度下該反應的平衡常數K=
.保持溫度和壓強不變,將各組分的物質的量都減少1mol,此時,容器的容積為,該反應的濃度商Q=.此時,平衡移動(填“向左”、“向右”或“不”)
Ⅱ.2007年度中國國家科學技術最高獎授予了石油化工催化專家閔恩澤,以表彰他在催化劑研究方面作出的突出貢獻.氯化汞(HgCl2)和氯化鋁(AlCl3)都有有機化工生產中常用的催化劑.
(1)氯化汞是一種能溶于水的白色固體,熔點276℃,是一種弱電解質,在水溶液中分步電離,寫出其第一步電離的方程式.
氯化汞可以被氯化亞鐵在溶液中還原為氯化亞汞(Hg2Cl2,白色沉淀),寫出該反應的離子方程式
若該反應是一個可逆反應,寫出在常溫下該反應的平衡常數表達式.
(2)無水氯化鋁用作石油裂解及催化重整的催化劑.能否直接加熱蒸干氯化鋁水溶液獲得無水氯化鋁?為什么?(用簡要的文字敘述和必要的化學方程式說明).發布:2024/11/18 8:0:1組卷:10引用:1難度:0.3


