中國擁有豐富的稀土礦產(chǎn)資源,探明的儲量居世界之首。稀土元素是指元素周期表中原子序數(shù)為57到71的15種鑭系元素,以及與鑭系元素化學(xué)性質(zhì)相似的銳(Sc)和釔(Y)共17種元素。請回答下列問題:
(1)鈧(Sc)原子的價電子排布式是 3d14s23d14s2。鈧元素的電離能如下表所示,鈧元素的常見化合價是 +3+3。
| I1 | I2 | I3 | I4 | |
| 電離能/kJ?mol-1 | 633 | 1235 | 2389 | 7019 |
8
8
,[NdCl2(H2O)6]Cl中存在的化學(xué)鍵除了配位鍵外還有 離子鍵、共價鍵
離子鍵、共價鍵
。用Nd2O3與鹽酸反應(yīng)制備NdCl3?6H2O的過程中,其溶劑可以是水或乙醇,為了減少配體中H20的個數(shù)增加Cl-的個數(shù),應(yīng)選用 乙醇
乙醇
做溶劑。(3)CeO2是有抗高溫氧化性能的催化劑載體。可以通過下列反應(yīng)制備:Ce2(C2O4)3
高溫
①CO2中中心原子的雜化類型為
sp
sp
雜化。已知CO的結(jié)構(gòu)式為C≡O(shè),則其分子中σ鍵的數(shù)目是 1
1
,其鍵長比碳氧雙鍵 短
短
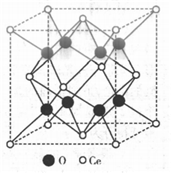
。②CeO2的晶胞結(jié)構(gòu)如圖所示,屬于面心立方點陣結(jié)構(gòu)。Ce的配位數(shù)為
8
8
。已知其晶胞參數(shù)α=0.54nm,若將晶胞左-后-下角上Ce的坐標(biāo)計為(0,0,0),則晶胞示意圖顯示的Ce原子中,坐標(biāo)為(1
2
1
2
2
0.27
6
0.27
nm。6
【答案】3d14s2;+3;8;離子鍵、共價鍵;乙醇;sp;1;短;8;0.27
6
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:10引用:1難度:0.5
相似題
-
 1.A、B、C、D、E、F是元素周期表中前四周期元素,且原子序數(shù)依次增大,其相關(guān)信息如下:
1.A、B、C、D、E、F是元素周期表中前四周期元素,且原子序數(shù)依次增大,其相關(guān)信息如下:
①A的周期序數(shù)等于其主族序數(shù);
②B、D原子的L層中都有兩個未成對電子;
③E元素原子最外層電子排布式為(n+1)Sn(n+1)Pn-1;
④F原子有四個能層,K、L、M全充滿,最外層只有一個電子.
試回答下列問題:
(1)基態(tài)E原子中,電子占據(jù)的最高能層符號為,F(xiàn)的價層電子排布式為.
(2)B、C、D的電負性由大到小的順序為(用元素符號填寫),C與A形成的分子CA3的VSEPR模型為.
(3)B和D分別與A形成的化合物的穩(wěn)定性:BA4小于A2D,原因是.
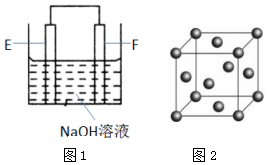
(4)以E、F的單質(zhì)為電極,組成如圖1所示的裝置,E極的電極反應(yīng)式為.
(5)向盛有F的硫酸鹽FSO4的試管里逐滴加入氨水,首先出現(xiàn)藍色沉淀,繼續(xù)滴加氨水,藍色沉淀溶解,得到深藍色溶液,再向深藍色透明溶液中加入乙醇,析出深藍色晶體.藍色沉淀溶解的離子方程式為.
(6)F的晶胞結(jié)構(gòu)(面心立方)如圖2所示:已知兩個最近的F的距離為acm,F的密度為g/cm3(阿伏加德羅常數(shù)用NA表示,F(xiàn)的相對原子質(zhì)量用M表示)發(fā)布:2025/1/18 8:0:1組卷:14引用:2難度:0.5 -
 2.鐵及其化合物在生產(chǎn)生活及科學(xué)研究方面應(yīng)用非常廣泛。
2.鐵及其化合物在生產(chǎn)生活及科學(xué)研究方面應(yīng)用非常廣泛。
(1)基態(tài)Fe原子的價層電子的電子排布圖為;其最外層電子的電子云形狀為。
(2)(NH4)2Fe(SO4)2?6H2O俗稱摩爾鹽
①NH4+電子式為。
②N、O兩元素的第一電離能由大到小的順序為(用元素符號表示)
③SO42-中S原子的雜化方式為,VSEPR模型名稱為。
(3)K3[Fe(CN)6]晶體中中心原子的配位數(shù)為;晶體的配位體為(用化學(xué)符號表示)
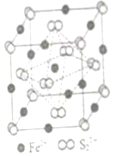
(4)FeS2晶體的晶胞如圖(c)所示。晶胞邊長為a nm、FeS2相對式量為M,阿伏加德羅常數(shù)的值為NA,其晶體密度的計算表達式為g?cm-3發(fā)布:2025/1/5 8:0:1組卷:7引用:1難度:0.7 -
 3.碳及其化合物有著重要用途。回答下列問題:
3.碳及其化合物有著重要用途。回答下列問題:
(1)基態(tài)碳原子的價層電子排布圖為。
(2)在CH2=CHCN中,碳原子的雜化方式有、,所含σ鍵數(shù)目和π鍵數(shù)目之比為。
(3)甲烷、水、氨氣中C、O、N原子均采用sp3雜化方式,VSEPR模型均為正四面體構(gòu)型,比較三者鍵角的大小(由大到小,用H一R-H表示),其原因是。
(4)C60室溫下為紫紅色固體,不溶于水,能溶于四氯化碳等非極性溶劑。據(jù)此判斷C60的晶體類型是。
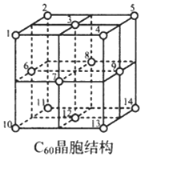
(5)C60晶胞結(jié)構(gòu)如圖,C60分子處于頂點和面心。已知:C60晶胞棱長為14.20? (1?=10-8cm),則C60的晶體密度為g/cm3。
C60體中存在正四面體空隙(例如1、3、6、7四點構(gòu)成)和正八面體空隙(例如3、6、7、8、9、12六點構(gòu)成),則平均每一個C60晶胞中有個正四面體空隙和4個正八面體空隙。當(dāng)堿金屬元素全部占滿所有空隙后,這類C60摻雜物才具有超導(dǎo)性。若用金屬銫(Cs)填滿所有空隙,距離最近的兩個Cs原子間的距離為?。發(fā)布:2025/1/5 8:0:1組卷:53引用:2難度:0.4
相關(guān)試卷


