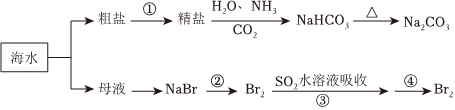
中國有廣闊的海岸線,建設發展海洋經濟、海水的綜合利用大有可為。空氣吹出法工藝,是目前“海水提溴”的最主要方法之一,其工藝流程如圖所示,試回答下列問題:

(1)海水日曬得到的鹽因為含有較多雜質,稱為粗鹽。為了得到精制鹽,可以用 過濾過濾的辦法除去其中的泥沙等不溶物。
(2)以上步驟Ⅰ中已獲得游離態的溴,步驟Ⅱ又將之轉變成化合態的溴,其目的是 富集溴元素富集溴元素。
(3)步驟②通入熱空氣或水蒸氣吹出Br2,利用了溴的 CC。
A.氧化性
B.還原性
C.揮發性
D.腐蝕性
(4)流程Ⅱ中涉及的離子反應方程式如下,請在下面橫線內填入適當的化學計量數:
33Br2+3CO32-3CO32-=BrO3-BrO3-+55Br-+33CO2↑
(5)上述流程中吹出的溴蒸氣,也可先用二氧化硫水溶液吸收,再用氯氣氧化后蒸餾。寫出溴與二氧化硫水溶液反應的離子方程式:SO2+Br2+2H2O=4H++2Br-+SO42-SO2+Br2+2H2O=4H++2Br-+SO42-。
(6)流程Ⅲ蒸餾過程中,溫度應控制在80~90℃.溫度過高或過低都不利于生產,請解釋原因:溫度過高,大量水蒸氣隨水排出,溴蒸氣中水增加,而溫度過低,溴不能完全蒸出,吸收率低溫度過高,大量水蒸氣隨水排出,溴蒸氣中水增加,而溫度過低,溴不能完全蒸出,吸收率低。
【考點】從海水中提取溴.
【答案】過濾;富集溴元素;C;3;3CO32-;BrO3-;5;3;SO2+Br2+2H2O=4H++2Br-+SO42-;溫度過高,大量水蒸氣隨水排出,溴蒸氣中水增加,而溫度過低,溴不能完全蒸出,吸收率低
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:33引用:5難度:0.5
相似題
-
1.海水是化學元素的寶庫,從海水中可以提取或生產多種化工原料,如食鹽、氯氣、單質溴、鎂、純堿等,它們在工農業生產中有著廣泛的用途.根據學過的知識回答下列問題:
(1)某化學興趣小組計劃用氯氣和氫氧化鈉制取簡易消毒液.
①其反應原理為:(用離子方程式表示).
②配制250mL 4.0mol?L-1NaOH溶液,需要用到的玻璃儀器,除燒杯、玻璃棒外,還必須用到的是.
(2)工業制得粗硅后,再與氯氣等物質發生反應,最終得到純硅.請寫出工業制取粗硅的化學方程式:
(3)金屬鎂被譽為“國防金屬”,若鎂起火,不能用CO2來滅火,其原因可用化學方程式表示為
(4)①若Na2CO3固體中混有少量NaHCO3雜質,除去雜質的方法是,
②若NaHCO3溶液中混有少量Na2CO3雜質,除去雜質的方法是.發布:2024/10/27 17:0:2組卷:11引用:1難度:0.5 -
2.海洋中有豐富的食品、礦產、能源、藥物和水產資源,下圖為海水利用的部分過程。下列有關說法不正確的是( )
A.制取NaHCO3的反應是利用其溶解度小于NaCl B.侯氏制堿應先通NH3再通CO2 C.在第②、③、④步驟中,溴元素均被氧化 D.③④的目的是進行溴的富集 發布:2024/12/30 3:30:1組卷:129引用:9難度:0.6 -
3.海水資源開發利用的部分過程如圖所示:

下列說法正確的是( )A.粗鹽(含Mg2+、Ca2+、 等)提純所加試劑順序為NaOH→Na2CO3→BaCl2→過濾→HClSO2-4B.過程①為了提高產率一般先通CO2再通NH3 C.用澄清石灰水可以鑒別NaHCO3和Na2CO3溶液 D.過程②③④可以達到富集溴的目的 發布:2024/11/3 6:0:1組卷:50引用:3難度:0.7


