綠礬(FeSO4?7H2O)的一種綜合利?,其?藝流程如圖(主要是生產還原鐵粉):
已知:隔絕空?進?“焙燒”時,FeCO3會分解生成氧化亞鐵和二氧化碳。
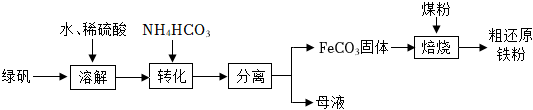
(1)綠礬溶解后,溶液中?量存在的?屬陽離?是 Fe2+Fe2+(填離?符號)。按照一般的物質分類?法,綠礬(FeSO4?7H2O)屬于 鹽鹽(填“氧化物”、“酸”、“堿”或“鹽”)。
(2)轉化步驟中,一般控制溫度不能超過30℃,其原因是 碳酸氫銨受熱易分解碳酸氫銨受熱易分解。
(3)在焙燒過程中作為還原劑的是一氧化碳。產生還原劑一氧化碳的反應化學?程式是 CO2+C 高溫 2COCO2+C 高溫 2CO;該?藝得到的粗還原鐵粉往往含有的雜質是 CC(填化學式)。
(4)在焙燒過程中需加?CaCO3進?脫硫處理。如圖1為加CaCO3和未加CaCO3對還原鐵粉產率的影響,據圖分析CaCO3的另一作?為 增?還原鐵粉的產率增?還原鐵粉的產率。
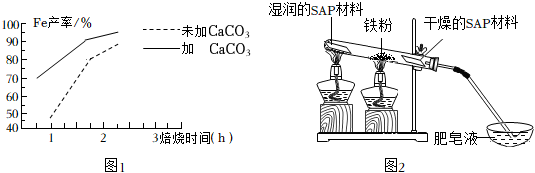
(5)粗還原鐵粉經加?處理后制得較為純凈的還原鐵粉,純還原鐵粉和?蒸?在?溫條件下,可制得四氧化三鐵(一種常?的磁性材料)同時生成一種?體,其裝置如圖2所示:SAP材料吸?性強,濕潤的SAP材料能為該反應持續(xù)提供?蒸?,實驗開始一段時間后,觀察到肥皂液中有?量的?泡產生,此?泡??柴即能點燃,同時有肥皂泡飄到空中,試寫出純還原鐵粉和?蒸?反應的化學?程式 3Fe+4H2O(氣體) 高溫 Fe3O4+4H23Fe+4H2O(氣體) 高溫 Fe3O4+4H2,?燥的SAP材料的作?是 吸收氫氣中的水蒸氣吸收氫氣中的水蒸氣。
高溫
高溫
高溫
高溫
【答案】Fe2+;鹽;碳酸氫銨受熱易分解;CO2+C 2CO;C;增?還原鐵粉的產率;3Fe+4H2O(氣體) Fe3O4+4H2;吸收氫氣中的水蒸氣
高溫
高溫
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網所有,未經書面同意,不得復制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:36引用:1難度:0.5
相似題
-
1.新冠肺炎疫情防控期間,西安市各學校開展全域噴灑低濃度、有效成分是次氯酸鈉的“84”消毒液進行消毒。如圖所示是模擬制備“84”消毒液的流程(Cl2是一種黃綠色的有毒氣體)。請回答下列問題:
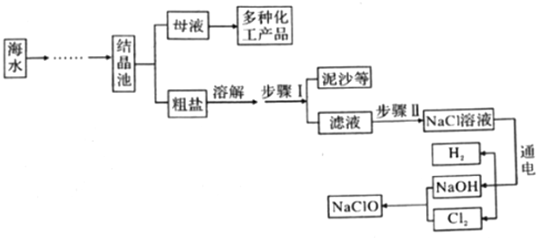
(1)NaOH的俗稱為(寫一種)。
(2)步驟Ⅱ中,通常用碳酸鈉溶液除去濾液中的氯化鈣雜質,請寫出有關反應的化學方程式。
(3)電解水時,一般在水中加入少量NaOH以增強水的導電性,不能加入NaCl的原因是。發(fā)布:2025/1/3 8:0:1組卷:6引用:1難度:0.5 -
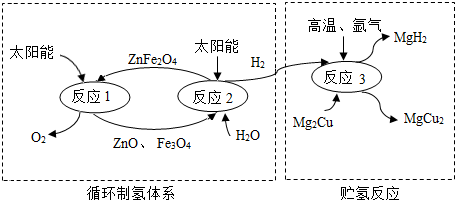 2.如圖是制取與貯存氫氣的一種方法,Mg2Cu是一種貯氫合金,吸氫后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列說法不正確的是( )
2.如圖是制取與貯存氫氣的一種方法,Mg2Cu是一種貯氫合金,吸氫后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列說法不正確的是( )A.ZnFe2O4中Fe的化合價為+3價 B.循環(huán)制氫反應中無需加入ZnFe2O4 C.反應1和反應2的總方程式為:2H2O 2H2↑+O2↑通電D.M與足量稀鹽酸反應生成的H2質量大于反應2產生的H2質量 發(fā)布:2024/12/31 8:0:1組卷:48引用:2難度:0.5 -
3.某種家用的消毒液的主要成分是次氯酸鈉(NaClO),制取NaClO的化學方程式為:Cl2+2NaOH=NaClO+NaCl+H2O,下列說法錯誤的是( )
A.NaClO中氯元素的化合價為-1 B.反應中用到的NaOH俗稱燒堿 C.該化學方程式中涉及到兩種鹽 D.反應前后氯元素化合價既升高又降低 發(fā)布:2025/1/3 8:0:1組卷:71引用:1難度:0.7
相關試卷


