新一代鋰二次電池體系和全固態鋰二次電池體系是化學、物理等學科的基礎理論研究與應用技術的前沿。
Ⅰ原電池是化學對人類的一項重大貢獻。實驗室為研究原電池原理,將a和b用導線連接,設計如圖裝置。

(1)Cu電極為原電池 正正極(填“正”或“負”),電極反應式為 2H++2e-=H2↑2H++2e-=H2↑。
(2)溶液中SO2-4移向 ZnZn極(填“Cu”或“Zn”)。
(3)若工作前兩極質量相等,工作一段時間后,導線中通過了1mol電子,則兩極的質量差為 32.532.5g。
Ⅱ將除銹后的鐵釘(含有少量的碳)用飽和食鹽水浸泡一下,放入如圖所示的具支試管中。

(4)幾分鐘后,可觀察到右邊導管中的水柱 升高升高(填“升高”或“降低”),水柱變化的原因是鐵釘發生了電化學腐蝕,寫出正極的電極反應式:O2+4e-+2H2O=4OH-O2+4e-+2H2O=4OH-
(5)Li-CuO二次電池的比能量高、工作溫度寬。Li-CuO二次電池中,金屬鋰作 負負極。比能量是指消耗單位質量的電極所釋放的電量,用來衡量電池的優劣,則Li、Na、Al分別作為電極時比能量由大到小的順序為 Li>Al>NaLi>Al>Na。
(6)鋰硒電池具有優異的循環穩定性。

①一種鋰硒電池放電時的工作原理如圖1所示,正極的電極反應式為 2Li++xSe+2e-=Li2Sex2Li++xSe+2e-=Li2Sex。
②Li2Sex與正極碳基體結合時的能量變化如圖2所示,圖中3種Li2Sex與碳基體的結合能力由大到小的順序是 Li2Se6>Li2Se4>Li2SeLi2Se6>Li2Se4>Li2Se。
SO
2
-
4
【考點】原電池與電解池的綜合.
【答案】正;2H++2e-=H2↑;Zn;32.5;升高;O2+4e-+2H2O=4OH-;負;Li>Al>Na;2Li++xSe+2e-=Li2Sex;Li2Se6>Li2Se4>Li2Se
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:31引用:3難度:0.5
相似題
-
1.某原電池結構如圖所示,下列有關該原電池的說法正確的是( )
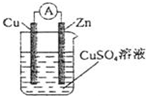
A.銅棒為負極 B.鋅棒發生還原反應 C.電子從銅棒經外電路流向鋅棒 D.鋅棒質量減輕 發布:2025/1/6 6:0:5組卷:417引用:11難度:0.9 -
2.關于如圖所示的原電池,下列說法正確的是( )
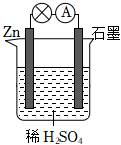
A.石墨電極上發生氧化反應 B.電子由鋅片通過導線流向石墨棒 C.該裝置將電能轉化為化學能 D.將稀硫酸換成乙醇,燈泡亮度不變 發布:2025/1/6 6:0:5組卷:83引用:5難度:0.8 -
3.一種新型短路膜電化學電池消除CO2裝置如圖所示。下列說法錯誤的是( )
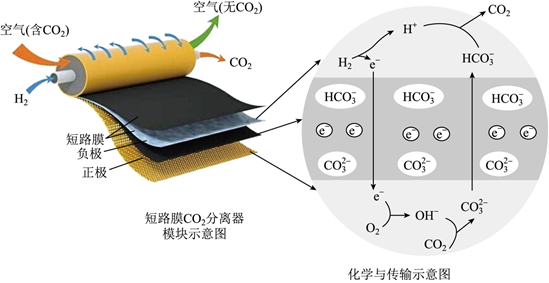
A.負極反應為:H2+2OH--2e-=2H2O B.正極反應消耗標準狀況下22.4LO2,理論上需要轉移4mol電子 C.短路膜和常見的離子交換膜不同,它既能傳遞離子,還可以傳遞電子 D.該裝置可用于空氣中CO2的捕獲,緩解溫室效應 發布:2024/12/30 19:30:2組卷:51引用:5難度:0.5


