當前位置:
試題詳情
專家提醒,成人每天食用6g加碘鹽就可滿足人的生理需要。生產加碘鹽通常是在食鹽中加入碘酸鉀(KIO3)。試回答下列問題:
(1)碘酸鉀中含有的非金屬元素是 碘元素、氧元素碘元素、氧元素。
(2)在KIO3中碘元素的化合價為 +5+5。
(3)某同學查閱資料得知:淀粉溶液遇碘變藍色。為檢驗某食用鹽試樣中是否含有碘元素,決定采用以下反應進行實驗:KIO3+5KI+3H2SO4(稀)═3I2+3K2SO4+3H2O。要達到實驗目的,除了KI、稀硫酸外,他還應選用的一種試劑是下列的 ①①(填序號)。
①淀粉溶液
②NaCl溶液
③K2SO4溶液
④NaOH溶液
【答案】碘元素、氧元素;+5;①
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/7/5 8:0:9組卷:0引用:1難度:0.6
相似題
-
1.加碘食鹽中碘元素以碘酸根(
)的形式存在.已知在酸性條件下,IO-3離子能跟碘離子(I-)發生反應生成碘(I2),碘能使淀粉變色,現提供下列試劑和生活中常見的物質:①碘化鉀溶液(溶液中含有I-)②白醋③白糖④白酒⑤淀粉⑥純堿.欲通過實驗證明加碘食鹽中存在碘酸根離子,必須選用的試劑和物質是( )IO-3A.①⑤⑥ B.①②③ C.①②⑤ D.②④⑥ 發布:2024/12/25 17:0:2組卷:70引用:2難度:0.9 -
2.平時我們吃的食物中的碘(元素符號為I)具有穩定性,而碘-131具有放射性,在核醫學中,它發出的射線作用于甲狀腺細胞,使細胞受到照射而破壞掉,使甲狀腺激素合成量減少,從而達到控制甲亢的目的.碘-131能與水發生化學反應,生成兩種酸.
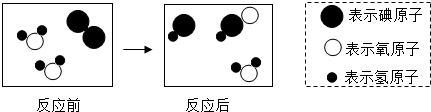
請根據圖示回答問題:
(1)寫出上述反應的化學方程式.該反應屬于反應(填寫“置換”“復分解”“氧化”之一).
(2)根據物質變化的微觀圖示,可知化學反應前后肯定發生變化的是(填寫下列各項的序號).
①元素的種類 ②原子的種類 ③分子的種類 ④原子的數目
(3)在生活中我們可用現象來檢驗碘單質的存在.發布:2024/11/6 8:0:1組卷:36引用:1難度:0.9 -
3.我國采用食鹽中加入碘酸鉀的方法防止缺碘引起的疾病.
(1)在人體中,碘是屬于(選填“常量”或“微量”)元素.
(2)碘酸鉀(KIO3)中鉀、碘、氧三種元素質量比為;它受熱易分解,烹飪時,添加加碘食鹽應注意.
(3)我國規定加碘食鹽含碘量為20mg/kg~50mg/kg.為測定某加碘食鹽是否為合格產品.在酸性條件下用足量KI溶液將其中KIO3全部轉化成I2.反應方程式為:KIO3+5KI+6HCl=6KCl+3I2+3H2O.稱取1000g某品牌加碘鹽樣品進行測定,經測定反應獲得的I2的質量為152.4mg,試通過計算說明該加碘食鹽是否為合格產品(計算過程寫在答題紙上).發布:2024/7/19 8:0:9組卷:82引用:7難度:0.3


