某化學興趣小組為探究銅跟濃硫酸的反應,用如圖所示裝置進行有關實驗。
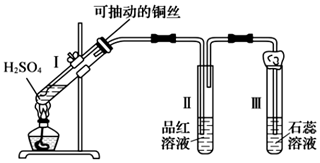
回答下列問題:
(1)試管Ⅰ中發生反應的化學方程式為 Cu+2H2SO4(濃) △ CuSO4+SO2↑+2H2OCu+2H2SO4(濃) △ CuSO4+SO2↑+2H2O。
(2)可抽動銅絲的作用是 抽動銅絲,以隨時止反應抽動銅絲,以隨時止反應。
(3)試管Ⅱ中現象為 品紅溶液褪色品紅溶液褪色,可證明 SO2具有漂白性SO2具有漂白性;試管Ⅲ中現象為 石蕊溶液顯紅色石蕊溶液顯紅色,可證明 SO2溶于水顯酸性SO2溶于水顯酸性。
(4)試管Ⅲ的管口用浸有NaOH溶液的棉團塞住,其作用是 吸收SO2氣體,防止空氣污染吸收SO2氣體,防止空氣污染;發生反應的化學方程式為 SO2+2NaOH=Na2SO3+H2OSO2+2NaOH=Na2SO3+H2O。
(5)該裝置中的一處錯誤可能導致實驗無法完成,請指出:試管II沒有用雙孔橡膠塞堵住試管口試管II沒有用雙孔橡膠塞堵住試管口。
(6)①實驗開始時,取a g銅絲和V mL 18 mol/L濃硫酸放在試管中共熱。反應進行一段時間后,銅絲還有剩余,且能伸入溶液內,但發現繼續加熱,銅絲不再溶解。該小組同學根據所學化學知識認為還有一定的硫酸剩余,你認為原因是 反應中濃硫酸被消耗的同時生成水,濃硫酸逐漸變稀,而Cu不能與稀硫酸反應反應中濃硫酸被消耗的同時生成水,濃硫酸逐漸變稀,而Cu不能與稀硫酸反應。
②該小組同學通過實驗測得剩余銅絲質量為bg(假設反應前后溶液的體積不變),則剩余硫酸的物質的量濃度為 18-125(a-b)4V18-125(a-b)4Vmol/L。
△
△
125
(
a
-
b
)
4
V
125
(
a
-
b
)
4
V
【答案】Cu+2H2SO4(濃) CuSO4+SO2↑+2H2O;抽動銅絲,以隨時止反應;品紅溶液褪色;SO2具有漂白性;石蕊溶液顯紅色;SO2溶于水顯酸性;吸收SO2氣體,防止空氣污染;SO2+2NaOH=Na2SO3+H2O;試管II沒有用雙孔橡膠塞堵住試管口;反應中濃硫酸被消耗的同時生成水,濃硫酸逐漸變稀,而Cu不能與稀硫酸反應;18-
△
125
(
a
-
b
)
4
V
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:5引用:1難度:0.6
相似題
-
1.下列依據實驗方案和現象對濃硫酸性質做出的判斷合理的是( )
實驗方案 實驗I: 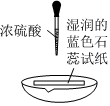
實驗Ⅱ: 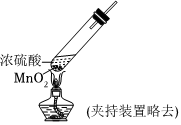
實驗現象 試紙中心區域變黑,邊緣變紅 黑色固體溶解,溶液接近無色(溶液中錳元素僅以Mn2+存在),產生能使帶火星的木條復燃的無色氣體 A.由Ⅰ可知,濃硫酸具有脫水性 B.由Ⅰ可知,濃硫酸具有弱酸性 C.由Ⅱ可知,濃硫酸具有強氧化性 D.由Ⅱ可知,濃硫酸具有吸水性 發布:2024/12/30 11:30:1組卷:171引用:8難度:0.5 -
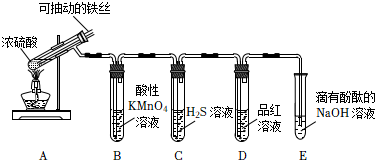 2.實驗室為探究鐵與足量濃硫酸的反應,并驗證SO2的性質,設計如圖所示裝置進行實驗,下列說法錯誤的是( )
2.實驗室為探究鐵與足量濃硫酸的反應,并驗證SO2的性質,設計如圖所示裝置進行實驗,下列說法錯誤的是( )A.實驗結束后,可取A中試管內的溶液稀釋后滴加KSCN溶液檢驗是否有Fe3+ B.B中溶液紫色褪去,C中生成淡黃色沉淀,均體現了SO2的還原性 C.D中品紅溶液褪色,體現了SO2的漂白性 D.E中溶液紅色變淺,體現了SO2酸性氧化物的性質 發布:2024/12/30 14:0:1組卷:116引用:3難度:0.7 -
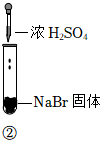
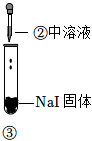
3.某小組同學探究濃硫酸的性質,向試管①、②中加入等量的98%的濃硫酸,實驗如下。下列對實驗的分析不合理的是( )
實驗1 實驗2 實驗3 裝置 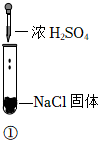
現象 溶液顏色無明顯變化;把蘸濃氨水的玻璃棒靠近試管口,產生白煙 溶液變黃;把濕潤的品紅試紙靠近試管口,試紙褪色 溶液變深紫色(經檢驗溶液含單質碘) A.實驗1中,白煙是NH4Cl B.根據實驗1和實驗2判斷還原性:Br->Cl- C.根據實驗3判斷還原性:I->Br- D.上述實驗體現了濃H2SO4的強氧化性、難揮發性等性質 發布:2024/12/30 7:30:1組卷:193引用:5難度:0.7


