錳元素能形成MnO、MnO2、Mn2O3和Mn3O4等多種氧化物,其中Mn3O4是重要的結構材料。工業(yè)用硫酸錳(MnSO4)制備Mn3O4的流程如下:
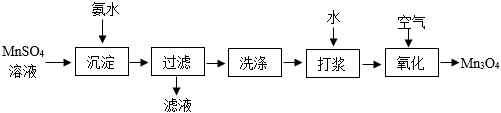
(1)“沉淀”反應是MnSO4+2NH3?H2O═Mn(OH)2↓+(NH4)2SO4。該反應的基本類型為 復分解反應復分解反應。
(2)寫出“過濾”所得濾液的一種用途:用作氮肥用作氮肥。
(3)將Mn(OH)2,加水“打漿”制成懸濁液,可加快“氧化”反應速率的原因是 增大了氫氧化錳與氧氣的接觸面積增大了氫氧化錳與氧氣的接觸面積。
(4)“氧化“時,Mn(OH)2,與空氣中的氧氣在60℃條件下反應生成Mn3O4,該反應的化學方程為 6Mn(OH)2+O2 60℃ 2Mn3O4+6H2O6Mn(OH)2+O2 60℃ 2Mn3O4+6H2O。
(5)通過測定固體產(chǎn)物中錳元素質量分數(shù)來推斷產(chǎn)物成分。“氧化“所得固體產(chǎn)物中錳元素質量分數(shù)隨通空氣時間的變化如圖所示。
①通空氣8小時左右,所得固體幾乎全部為Mn3O4。推出該結論的依據(jù)是 錳元素的氧化物中,Mn3O4中錳元素的質量分數(shù)最接近72%,通空氣8小時左右,所得固體中錳元素質量分數(shù)最接近72%,因此幾乎全部為Mn3O4錳元素的氧化物中,Mn3O4中錳元素的質量分數(shù)最接近72%,通空氣8小時左右,所得固體中錳元素質量分數(shù)最接近72%,因此幾乎全部為Mn3O4。
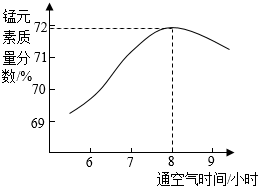
②通空氣超過8小時,產(chǎn)物中錳元素質量分數(shù)減小的原因是 Mn3O4被繼續(xù)氧化成MnO2、Mn2O3等物質Mn3O4被繼續(xù)氧化成MnO2、Mn2O3等物質。
60
℃
60
℃
【答案】復分解反應;用作氮肥;增大了氫氧化錳與氧氣的接觸面積;6Mn(OH)2+O2 2Mn3O4+6H2O;錳元素的氧化物中,Mn3O4中錳元素的質量分數(shù)最接近72%,通空氣8小時左右,所得固體中錳元素質量分數(shù)最接近72%,因此幾乎全部為Mn3O4;Mn3O4被繼續(xù)氧化成MnO2、Mn2O3等物質
60
℃
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:837引用:3難度:0.5
相似題
-
1.新冠肺炎疫情防控期間,西安市各學校開展全域噴灑低濃度、有效成分是次氯酸鈉的“84”消毒液進行消毒。如圖所示是模擬制備“84”消毒液的流程(Cl2是一種黃綠色的有毒氣體)。請回答下列問題:
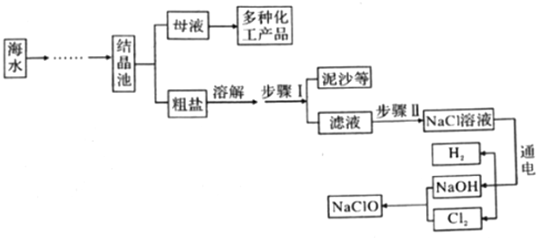
(1)NaOH的俗稱為(寫一種)。
(2)步驟Ⅱ中,通常用碳酸鈉溶液除去濾液中的氯化鈣雜質,請寫出有關反應的化學方程式。
(3)電解水時,一般在水中加入少量NaOH以增強水的導電性,不能加入NaCl的原因是。發(fā)布:2025/1/3 8:0:1組卷:6引用:1難度:0.5 -
2.某種家用的消毒液的主要成分是次氯酸鈉(NaClO),制取NaClO的化學方程式為:Cl2+2NaOH=NaClO+NaCl+H2O,下列說法錯誤的是( )
A.NaClO中氯元素的化合價為-1 B.反應中用到的NaOH俗稱燒堿 C.該化學方程式中涉及到兩種鹽 D.反應前后氯元素化合價既升高又降低 發(fā)布:2025/1/3 8:0:1組卷:71引用:1難度:0.7 -
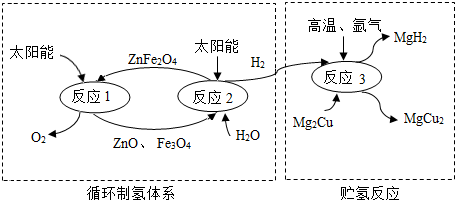 3.如圖是制取與貯存氫氣的一種方法,Mg2Cu是一種貯氫合金,吸氫后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列說法不正確的是( )
3.如圖是制取與貯存氫氣的一種方法,Mg2Cu是一種貯氫合金,吸氫后生成MgH2和MgCu2合金的混合物(M),MgH2+2HCl═MgCl2+2H2↑,下列說法不正確的是( )A.ZnFe2O4中Fe的化合價為+3價 B.循環(huán)制氫反應中無需加入ZnFe2O4 C.反應1和反應2的總方程式為:2H2O 2H2↑+O2↑通電D.M與足量稀鹽酸反應生成的H2質量大于反應2產(chǎn)生的H2質量 發(fā)布:2024/12/31 8:0:1組卷:48引用:2難度:0.5
相關試卷


