海洋是巨大的資源寶庫。“筑夢”學習小組模擬化工廠生產流程,利用海水制取純堿和金屬鎂,設計方案如圖所示。請回答下列問題。

(1)流程Ⅰ為海水曬鹽的過程。結晶池中析出晶體后的母液是氯化鈉的 飽和飽和(填“飽和”或“不飽和”)溶液。
(2)流程Ⅱ為除去粗鹽水中的CaCl2、MgCl2、Na2SO4和雜質。加入下列3種過量試劑的順序依次可以是 BCBC(填字母序號)。
A.Na2CO3、NaOH、BaCl2
B.BaCl2、Na2CO3、NaOH
C.NaOH、BaCl2、Na2CO3
其中除去硫酸鈉反應的實質為 鋇離子與硫酸根離子結合成硫酸鋇沉淀鋇離子與硫酸根離子結合成硫酸鋇沉淀。碳酸鈉的作用是除去 Ca2+、Ba2+Ca2+、Ba2+(填離子符號)。
(3)流程Ⅲ為海水“制堿”。制取小蘇打(碳酸氫鈉)通入的氣體X的化學式為 CO2CO2;在該流程中,是先向飽和食鹽水中通入過量的氨氣,然后再通入過量的該氣體,先通入過量氨氣的目的是 使溶液呈堿性,有利于吸收CO2使溶液呈堿性,有利于吸收CO2。此反應的化學方程式為 NaCl+H2O+CO2+NH3=NaHCO3↓+NH4ClNaCl+H2O+CO2+NH3=NaHCO3↓+NH4Cl。
(4)流程Ⅳ為海水提鎂。氫氧化鎂和鹽酸反應的化學方程式為 2HCl+Mg(OH)2=MgCl2+2H2O2HCl+Mg(OH)2=MgCl2+2H2O。海水中本來就有氯化鎂,不直接將海水進行電解來制取金屬鎂,而是經過了加石灰乳、鹽酸等過程,目的是 富集并提純氯化鎂富集并提純氯化鎂。
【答案】飽和;BC;鋇離子與硫酸根離子結合成硫酸鋇沉淀;Ca2+、Ba2+;CO2;使溶液呈堿性,有利于吸收CO2;NaCl+H2O+CO2+NH3=NaHCO3↓+NH4Cl;2HCl+Mg(OH)2=MgCl2+2H2O;富集并提純氯化鎂
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/5/23 8:0:8組卷:46引用:1難度:0.4
相似題
-
1.閩東的淡水和海水資源豐富
(1)興趣小組測量集中水樣的pH,得到下表數據,其中堿性最強的是(填序號)
(2)山泉水含有較多鈣、鎂離子,硬度較高水樣 來源 pH A 泉水:“海上仙都”-太姥山 6.8~7.0 B 河水:“海國桃園”-楊家溪 7.2~7.6 C 海水:“天然良港”-三都澳 7.8~8.0
①寫出鈣離子的符號
②若要降低其硬度,可采用的方法是(寫一種)
(3)海水是重要資源,處理的大致流程如圖: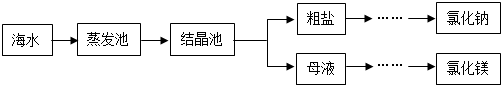
①粗鹽經過溶解、過濾、蒸發可除去海沙等不溶性雜質.
a.海沙的主要成分是二氧化硅(SiO2),其中Si的化合價為.
b.若以上操作在實驗室中進行,溶解時,玻璃棒的作用是.
②母液經過處理,可得氯化鎂,點解熔融氯化鎂生成鎂和氯氣(Cl2).寫出電解氯化鎂的化學方程式:.發布:2024/12/22 8:0:1組卷:13引用:1難度:0.5 -
2.我國的領海主權不容侵犯,南海是我國的固有領海,蘊藏著豐富的海洋資源。
(1)南海不僅蘊含著大量的煤、石油、天然氣等常規能源,還蘊藏著大量的可燃冰。可燃冰(主要成分是CH4)被科學家譽為“未來能源”,CH4燃燒的化學方程式,可燃冰作為能源與煤、石油相比的優點是。
(2)南海某島采用風力發電提供的電能對海水進行了如圖1所示的綜合利用。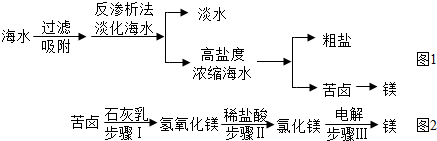
①反滲析法淡化海水是利用海水中各成分的不同分離出淡水。
②將高鹽度濃縮海水進行可以分離得到粗鹽。
③用苦鹵制取金屬鎂的流程圖如圖2:
上述轉化過程中,所發生的反應屬于復分解反應類型的步驟是(填序號),步驟Ⅱ的化學方程式為。利用苦鹵制取氫氧化鎂比“直接向海水中加入石灰乳制取氫氧化鎂”的優勢是。
(3)如圖3是海水“制堿”的部分簡單流程。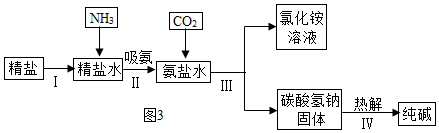
①步驟IⅡ反應的化學方程式為;
②制氨鹽水的過程中要先通入氨氣,再通入二氧化碳,如果反過來,二氧化碳的吸收率會降低,這是因為;
③氨鹽水吸收二氧化碳后生成碳酸氫鈉和氯化銨,首先析出的物質是,原因是,將氯化銨溶液和碳酸氫鈉固體分離的方法是過濾,濾液中的溶質有。發布:2024/12/25 12:0:1組卷:85引用:4難度:0.6 -
3.海洋是人類巨大的資源寶庫,其中含有的可溶性物質包括MgCl2等。如圖為從海水中提取金屬鎂的簡易流程圖。

(1)海洋中含量最多的物質是。
(2)貝殼煅燒的化學方程式是。
(3)操作Ⅰ的名稱是,進行該操作時,用到的玻璃儀器有燒杯、玻璃棒和。其中玻璃棒的作用是。
(4)生石灰轉化為石灰乳的過程是反應(選填“吸熱”或“放熱”)。
(5)寫出氫氧化鎂和鹽酸反應的化學方程式。
(6)上述流程中未涉及到的基本反應類型是反應。發布:2024/12/24 12:0:2組卷:221引用:4難度:0.2


