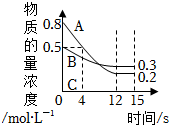
 已知:反應aA(g)+bB(g)?cC(g)某溫度下,在2L的密閉容器中投入一定量的A、B,兩種氣體的物質的量濃度隨時間變化的曲線如圖所示。
已知:反應aA(g)+bB(g)?cC(g)某溫度下,在2L的密閉容器中投入一定量的A、B,兩種氣體的物質的量濃度隨時間變化的曲線如圖所示。
(1)從反應開始到12s時,用A表示的 反應速率為 0.05mol/(L?s)0.05mol/(L?s);
(2)經測定前4s內v(C)=0.05mol?L-1?s-1,則該反應的化學方程式為 3A(g)+B(g)?2C(g)3A(g)+B(g)?2C(g);
(3)請在圖中將生成物C的物質的量濃度隨時間的變化曲線繪制出來;
(4)若上述反應分別在甲、乙、丙 三個相同的密閉容器中進行,經同一段時間后,測得三個容器中的反應速率分別為:
甲:v(A)=0.3mol?L-1?s-1;
乙:v(B)=0.12mol?L-1?s-1;
丙:v(C)=9.6mol?L-1?min-1;
則甲、乙、丙三個容器中反應速率由快到慢的順序為 乙>甲>丙乙>甲>丙。
【考點】反應速率的定量表示方法;化學平衡的影響因素.
【答案】0.05mol/(L?s);3A(g)+B(g)?2C(g);乙>甲>丙
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:213引用:6難度:0.5
相似題
-
1.某化學反應的反應物濃度在20s內由3.0mol/L變為1.0mol/L,則以該反應物濃度的變化表示20s內的平均反應速率為( )
A.0.05 mol/(L?s) B.0.10 mol/(L?s) C.0.15 mol/(L?s) D.2.0 mol/(L?s) 發布:2024/12/30 3:30:1組卷:298引用:6難度:0.7 -
2.在N2+3H2?2NH3的反應中,經過一段時間后,NH3的濃度增加了0.6mol/L,在此段時間內用H2表示的平均反應速率為0.45mol/(L?s),則此段時間是( )
A.1 s B.2 s C.44 s D.1.33 s 發布:2024/12/30 13:30:2組卷:358引用:10難度:0.9 -
3.在一定條件下,將2mol A和1mol B混合于固定容積為2L的密閉容器中,發生如下反應:
,5s時測得氣體壓強是反應前的3A(g)+B(g)xC(g)+2D(g),此段時間內C的平均生成率為( )56A.0.25mol/L/s B.0.1 C.0.05mol/(L?s) D.條件不足,無法計算 發布:2024/12/30 19:0:1組卷:100引用:3難度:0.9


