氧化還原反應(yīng)在生產(chǎn)生活中有很多實(shí)際應(yīng)用:
Ⅰ.二氧化硒(SeO2)是一種氧化劑,其被還原后的單質(zhì)硒可能成為環(huán)境污染物,通過與濃HNO3或濃H2SO4反應(yīng)生成SeO2以回收Se。
已知:①Se+2H2SO4(濃)═2SO2↑+SeO2+2H2O
②2SO2+SeO2+2H2O═Se+2SO2-4+4H+。
(1)Se與濃H2SO4的反應(yīng)中,氧化劑是濃H2SO4濃H2SO4,還原劑是SeSe。
(2)依據(jù)反應(yīng)①判斷SeO2、濃H2SO4的氧化性強(qiáng)弱是:SeO2小于小于濃H2SO4(填大于、小于或等于)
(3)用雙線橋法標(biāo)出反應(yīng)②電子轉(zhuǎn)移的方向和數(shù)目:
 。
。
(4)SeO2、KI和HNO3發(fā)生如下反應(yīng),配平該反應(yīng)的化學(xué)方程式。
11SeO2+44KI+44HNO3→11Se+22I2+44KNO3+22H2O
Ⅱ.對(duì)工業(yè)廢水和生活污水進(jìn)行處理是防止水體污染、改善水質(zhì)的主要措施。
(5)含氰廢水中的CN-有劇毒。在微生物的作用下,CN-能夠被氧氣氧化成HCO-3,同時(shí)生成NH3,該反應(yīng)的離子方程式為2CN-+4H2O+O2 微生物 2HCO-3+2NH32CN-+4H2O+O2 微生物 2HCO-3+2NH3。
SO
2
-
4


HCO
-
3
微生物
HCO
-
3
微生物
HCO
-
3
【考點(diǎn)】氧化還原反應(yīng)的基本規(guī)律及應(yīng)用;氧化還原反應(yīng)方程式的配平;雙線橋法;化學(xué)方程式的書寫;氧化性、還原性強(qiáng)弱的比較;離子方程式的書寫.
【答案】濃H2SO4;Se;小于; ;1;4;4;1;2;4;2;2CN-+4H2O+O2 2+2NH3
;1;4;4;1;2;4;2;2CN-+4H2O+O2 2+2NH3
 ;1;4;4;1;2;4;2;2CN-+4H2O+O2
;1;4;4;1;2;4;2;2CN-+4H2O+O2微生物
HCO
-
3
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:30引用:2難度:0.5
相似題
-
1.關(guān)于反應(yīng)KClO3+6HCl=KCl+3Cl2↑+3H2O,下列說法正確的是( )
A.被氧化的氯原子與被還原的氯原子的個(gè)數(shù)之比為5:1 B.HCl在反應(yīng)中只表現(xiàn)出還原性 C.氧化性:KClO3<Cl2 D.用雙線橋法表示電子得失情況: 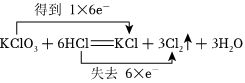 發(fā)布:2024/11/7 11:0:1組卷:285引用:6難度:0.5
發(fā)布:2024/11/7 11:0:1組卷:285引用:6難度:0.5 -
2.銅和稀硝酸可以發(fā)生如下反應(yīng):Cu+HNO3→Cu(NO3)2+NO↑+H2O(未配平),下列說法中正確的是( )
A.反應(yīng)結(jié)束后,溶液的導(dǎo)電性明顯增強(qiáng) B.反應(yīng)物中的Cu和稀硝酸均可導(dǎo)電,屬于電解質(zhì) C.氧化劑與還原劑分子數(shù)之比為8:3 D.每生成1個(gè)NO分子,反應(yīng)轉(zhuǎn)移3個(gè)電子 發(fā)布:2024/12/21 8:0:2組卷:26引用:1難度:0.7 -
3.已知G、Q、X、Y、Z均為含氯元素的化合物,在一定條件下有下列轉(zhuǎn)化關(guān)系(未配平):
①G→Q+NaCl
②Q+H2OX+H2通電
③Y+NaOH→G+Q+H2O
④Z+NaOH→Q+X+H2O
這五種化合物中Cl元素化合價(jià)由低到高的順序是( )A.G、Y、Q、Z、X B.X、Z、Q、G、Y C.X、Z、Q、Y、G D.G、Q、Y、Z、X 發(fā)布:2024/11/13 13:0:1組卷:407引用:18難度:0.9


