氮在自然界中的轉化是一個復雜的過程,氮循環是生態系統物質循環的重要組成部分。
(1)在一定條件 下,NH3可用于脫除氮氧化物的煙氣,其反應原理為4xNH3+6NOx 一定條件 (2x+3)N2+6xH2O。該反應中的還原劑為 NH3NH3(填化學式)。
(2)氨的催化氧化是制備硝酸的重要過程,實驗室按如圖所示裝置進行氨的催化氧化實驗。
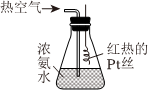
實驗操作:將濃氨水倒入錐形瓶中,從導氣管通入熱空氣,將紅熱的鉑絲伸入錐形瓶中。
實驗現象:a.紅熱的鉑絲始終保持紅熱狀態;b.瓶中有紅棕色氣體生成,瓶內還有白煙生成。
回答下列問題:
①鉑絲始終保持紅熱狀態的可能原因是 氨氣的催化氧化屬于放熱反應氨氣的催化氧化屬于放熱反應。
②通入熱空氣的作用是 促進氨水分解,逸出氨氣,并提供氧氣促進氨水分解,逸出氨氣,并提供氧氣。
③請寫出氨氣的催化氧化反應的化學方程式:4NH3+5O2 鉑絲 △4NO+6H2O4NH3+5O2 鉑絲 △4NO+6H2O。
④紅棕色氣體的化學式為 NO2NO2,此氣體可用NaOH溶液吸收,有NaNO2和NaNO3生成,寫出該反應的離子方程式:2NO2+2OH-=NO-2+NO-3+H2O2NO2+2OH-=NO-2+NO-3+H2O。
(3)氨是氮循環中的重要物質,在人類的生產和生活中有著廣泛的應用。高濃度的氨氮廢水是造成河流及湖泊富營養化的主要因素,研究表明在微生物作用下,可實現NH+4→NO-3的轉化。寫出在堿性條件下,NH+4被氧氣氧化為NO-3的反應的離子方程式:NH+4+2O2=NO-3+H2ONH+4+2O2=NO-3+H2O。每生成1molNO-3,轉移的電子的物質的量為 88mol。再往含NO-3 的廢水中加入甲醇,可將NO-3轉化為N2,實現廢水的無害化處理。
一定條件
鉑絲
△
鉑絲
△
NO
-
2
NO
-
3
NO
-
2
NO
-
3
NH
+
4
NO
-
3
NH
+
4
NO
-
3
NH
+
4
NO
-
3
NH
+
4
NO
-
3
mol
NO
-
3
NO
-
3
NO
-
3
【答案】NH3;氨氣的催化氧化屬于放熱反應;促進氨水分解,逸出氨氣,并提供氧氣;4NH3+5O2 4NO+6H2O;NO2;2NO2+2OH-=++H2O;+2O2=+H2O;8
鉑絲
△
NO
-
2
NO
-
3
NH
+
4
NO
-
3
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:32引用:3難度:0.8
相似題
-
1.下列關于自然界中氮循環(如圖)的說法不正確的是( )
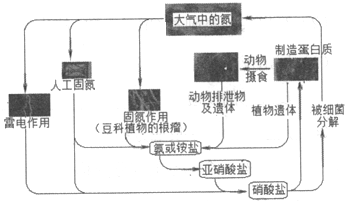
A.人工固氮可以得到硝酸鹽 B.雷電作用可將氮氣直接轉化為銨鹽 C.細菌對氮元素的循環有重要作用 D.亞硝酸鹽轉化為硝酸鹽的過程中,氮元素被氧化 發布:2024/12/30 4:0:1組卷:141引用:2難度:0.9 -
2.硫和氮及其化合物在生產生活中應用廣泛,含氮氧化物和硫氧化物的尾氣需處理后才能排放。請回答下列問題:
(1)稀硫酸、稀硝酸與銅粉反應制膽礬晶體,過程中生成一種無色氣體,該氣體是(填化學式),制得的膽礬晶體中可能存在的雜質是(填名稱)。
(2)Na2SO3是實驗室重要的常見藥品,有一瓶放置了很久,小明同學想設計一個實驗驗證這瓶藥品是否變質。請你幫助他設計一個實驗。
(3)一種NH3催化還原NO的物質轉化如圖所示。若參與反應的NH3和O2物質的量之比為4:1,寫出轉化時總反應的化學方程式:。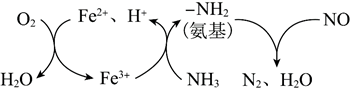
(4)利用氨水可以將SO2和NO2吸收,原理如圖所示: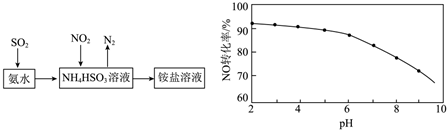
NO2被吸收的離子方程式是。
(5)在酸性NaClO溶液中,HClO氧化NO生成Cl-和。其他條件相同,NO轉化為NO-3的轉化率隨NaClO溶液初始pH(用稀鹽酸調節)的變化如圖所示。NaClO溶液的初始pH越小,NO轉化率越高。其原因是NO-3。發布:2024/12/30 3:30:1組卷:56引用:1難度:0.5 -
3.下列關于氮的氧化物的說法中正確的是( )
A.氮的氧化物都是酸性氧化物,都是大氣污染物 B.氮的氧化物都既有氧化性,又有還原性 C.NO2與H2O反應生成 HNO3,所以NO2是酸性氧化物 D.可用排空氣法收集NO2 發布:2024/12/30 6:0:2組卷:28引用:2難度:0.5


