2-硝基-1,3-苯二酚是重要的醫(yī)藥中間體。實驗室常以間苯二酚為原料,經(jīng)磺化、硝化、去磺酸基三步合成:
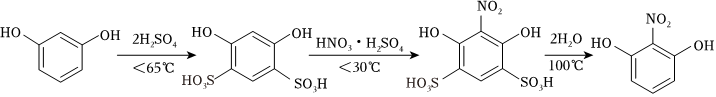
部分物質(zhì)相關(guān)性質(zhì)如下表:
| 名稱 | Mr | 性狀 | 熔點/℃ | 水溶性(常溫) |
| 間苯二酚 | 110 | 白色針狀晶體 | 110.7 | 易溶 |
| 2-硝基-1,3-苯二酚 | 155 | 桔紅色針狀晶體 | 87.8 | 難溶 |
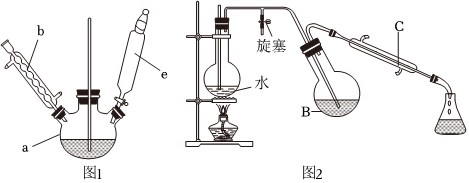
第一步:磺化。稱取77.0g間苯二酚,碾成粉末放入燒瓶中,慢慢加入適量濃硫酸并不斷攪拌,控制溫度在一定范圍內(nèi)攪拌15min(如圖1)。
第二步:硝化。待磺化反應結(jié)束后將燒瓶置于冷水中,充分冷卻后加入“混酸”,控制溫度繼續(xù)攪拌15min。
第三步:蒸餾。將硝化反應混合物的稀釋液轉(zhuǎn)移到圓底燒瓶B中,然后用如圖2所示裝置進行水蒸氣蒸餾(水蒸氣蒸餾可使待提純的有機物在低于100℃的情況下隨水蒸氣一起被蒸餾出來,從而達到分離提純的目的),收集餾出物,得到2-硝基-1,3-苯二酚粗品。
請回答下列問題:
(1)圖1中儀器a的名稱是
三頸燒瓶
三頸燒瓶
;磺化步驟中控制溫度最合適的范圍為 B
B
(填字母代號,下同)。A.30~60℃
B.60~65℃
C.65~70℃
D.70~100℃
(2)已知:酚羥基鄰對位的氫原子比較活潑,均易被取代。請分析第一步磺化引入磺酸基基團(-SO3H)的作用是
防止硝基取代兩個酚羥基對位上的氫原子,降低2-硝基-1,3-苯二酚的產(chǎn)率
防止硝基取代兩個酚羥基對位上的氫原子,降低2-硝基-1,3-苯二酚的產(chǎn)率
。(3)硝化步驟中制取“混酸”的具體操作是
在燒杯中加入適量的濃硝酸,沿杯壁緩慢加入一定量的濃硫酸,邊加邊攪拌,并冷卻
在燒杯中加入適量的濃硝酸,沿杯壁緩慢加入一定量的濃硫酸,邊加邊攪拌,并冷卻
。(4)水蒸氣蒸餾是分離和提純有機物的方法之一,被提純物質(zhì)必須具備的條件正確的是
BD
BD
。A.具有較低的熔點
B.不溶或難溶于水,便于最后分離
C.難揮發(fā)性
D.在沸騰下與水不發(fā)生化學反應
(5)下列說法正確的是
AC
AC
。A.直型冷凝管內(nèi)壁中可能會有紅色晶體析出
B.反應一段時間后,停止蒸餾,先熄滅酒精燈,再打開旋塞,最后停止通冷凝水
C.燒瓶A中長玻璃管起穩(wěn)壓作用,既能防止裝置中壓強過大引起事故,又能防止壓強過小引起倒吸
(6)蒸餾所得2-硝基-1,3-苯二酚中仍含少量雜質(zhì),可用少量乙醇水混合劑洗滌。請設(shè)計簡單實驗證明2-硝基-1,3-苯二酚已經(jīng)洗滌干凈
取少量洗滌液,滴加BaCl2溶液,若無沉淀產(chǎn)生,證明已經(jīng)洗滌干凈
取少量洗滌液,滴加BaCl2溶液,若無沉淀產(chǎn)生,證明已經(jīng)洗滌干凈
。(7)本實驗最終獲得15.5g桔紅色晶體,則2-硝基-1,3-苯二酚的產(chǎn)率約為
14.3%
14.3%
(保留3位有效數(shù)字)。【考點】制備實驗方案的設(shè)計.
【答案】三頸燒瓶;B;防止硝基取代兩個酚羥基對位上的氫原子,降低2-硝基-1,3-苯二酚的產(chǎn)率;在燒杯中加入適量的濃硝酸,沿杯壁緩慢加入一定量的濃硫酸,邊加邊攪拌,并冷卻;BD;AC;取少量洗滌液,滴加BaCl2溶液,若無沉淀產(chǎn)生,證明已經(jīng)洗滌干凈;14.3%
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/4/20 14:35:0組卷:58引用:4難度:0.5
相似題
-
1.硫鐵礦燒渣是硫鐵礦生產(chǎn)硫酸過程中產(chǎn)生的工業(yè)廢渣(主要含F(xiàn)e2O3及少量SiO2、Al2O3、CaO、MgO等雜質(zhì)).用該燒渣制取藥用輔料--紅氧化鐵的工藝流程如圖:
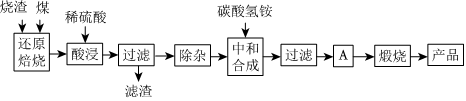
(1)在“還原焙燒”中產(chǎn)生的有毒氣體可能有.
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示).
(3)根據(jù)下表數(shù)據(jù):
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,檢驗Fe3+已經(jīng)除盡的試劑是;當pH=5時,溶液中c(Al3+)=mol?L-1(已知常溫下Ksp[Al(OH)3]=2.0×10-33).
(4)“中和合成”的目的是將溶液中Fe2+轉(zhuǎn)變?yōu)樘妓醽嗚F沉淀,則A的操作是.
(5)a g燒渣經(jīng)過上述工藝可得紅氧化鐵b g.藥典標準規(guī)定,制得的紅氧化鐵中含氧化鐵不得少于98.0%,則所選用的燒渣中鐵的質(zhì)量分數(shù)應不低于(用含a、b的表達式表示).發(fā)布:2025/1/19 8:0:1組卷:114引用:4難度:0.5 -
2.硫鐵礦燒渣是硫鐵礦生產(chǎn)硫酸過程中產(chǎn)生的工業(yè)廢渣(主要含F(xiàn)e2O3及少量SiO2、Al2O3等雜質(zhì)).用該燒渣制取藥用輔料--紅氧化鐵的工藝流程如下:
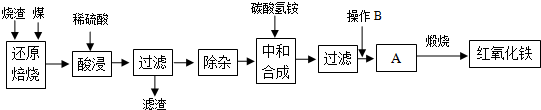
(1)在“還原焙燒”中產(chǎn)生的有毒氣體可能有.
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示).
(3)根據(jù)下表數(shù)據(jù):
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 2.01 7.11 完全沉淀的pH 4.77 3.68 9.61 ,檢驗
Fe3+已經(jīng)除盡的試劑是.
(4)“中和合成”的目的是將溶液中Fe2+轉(zhuǎn)變?yōu)樘妓醽嗚F沉淀,則操作B是.
(5)煅燒A的反應方程式是.
(6)a g燒渣經(jīng)過上述工藝可得紅氧化鐵b g.藥典標準規(guī)定,制得的紅氧化鐵中含氧化鐵不得少于98.0%,則所選用的燒渣中鐵的質(zhì)量分數(shù)應不低于(用含a、b的表達式表示).發(fā)布:2025/1/19 8:0:1組卷:5引用:1難度:0.5 -
3.硫鐵礦燒渣是硫鐵礦生產(chǎn)硫酸過程中產(chǎn)生的工業(yè)廢渣(主要含F(xiàn)e2O3及少量SiO2、Al2O3、CaO、MgO等雜質(zhì)).用該燒渣制取藥用輔料--紅氧化鐵的工藝流程如下:
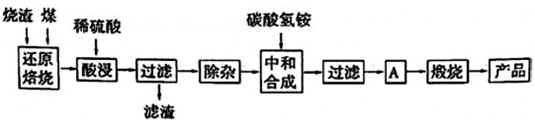
(1)在“還原焙燒”中產(chǎn)生的有毒氣體可能有.
(2)“酸浸”時間一般不超過20min,若在空氣中酸浸時間過長,溶液中Fe2+含量將下降,其原因是(用離子方程式表示).
(3)根據(jù)下表數(shù)據(jù):
在“除雜”步驟中,為除去Fe3+和Al3+,溶液的pH最大值應小于氫氧化物 Al(OH)3 Mg(OH)2 Fe(OH)3 Fe(OH)2 開始沉淀的pH 3.10 8.54 2.01 7.11 完全沉淀的pH 4.77 11.04 3.68 9.61 ,常溫下,當pH=5時,溶液中c(Al3+)=mol?L-1(已知常溫下Ksp[Al(OH)3]═2.0×10-33).
(4)“中和合成”的目的是將溶液中Fe2+轉(zhuǎn)變?yōu)樘妓醽嗚F沉淀,則A的操作是.發(fā)布:2025/1/19 8:0:1組卷:12引用:1難度:0.5
相關(guān)試卷


