 銅單質及其化合物是應用極其廣泛的物質。
銅單質及其化合物是應用極其廣泛的物質。
(1)銅是氫后金屬,不能與鹽酸發生置換反應,但將單質銅置于濃氫碘酸中,會有可燃性氣體及白色沉淀生成,又知氧化性:Cu2+>I2,則銅與氫碘酸反應的化學方程式為2Cu+2HI=2CuI+H2↑2Cu+2HI=2CuI+H2↑
(2)已知Cu2O能溶于醋酸溶液或鹽酸中,同時得到藍色溶液和紅色固體,則Cu2O與稀硫酸反應的離子方程式為Cu2O+2H+=Cu+H2O+Cu2+Cu2O+2H+=Cu+H2O+Cu2+;Cu2O與稀硝酸反應的離子方程式為3Cu2O+14H++2NO=6Cu2++2NO↑+7H2O3Cu2O+14H++2NO=6Cu2++2NO↑+7H2O;
只用稀硫酸來確定某紅色固體是 Cu2O與Cu組成的混合物的方法:稱取m g該紅色固體置于足量稀硫酸中,充分反應后過濾,然后洗滌、干燥剩余固體后稱量,固體質量大于4m9g洗滌、干燥剩余固體后稱量,固體質量大于4m9g。
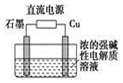
(3)Cu2O是一種半導體材料,基于綠色化學理念設計的制取Cu2O的電解裝置如圖所示,電解總反應:2Cu+H2O 電解 Cu2O+H2↑,則石墨應與電源的負負極相連,銅電極上的電極反應式為2Cu-2e-+2OH-=Cu2O+H2O2Cu-2e-+2OH-=Cu2O+H2O;電解過程中,陰極區周圍溶液pH變大變大(填“變大”、“變小”或“不變”)。
(4)現向Cu、Cu2O、CuO組成的混合物中加入1L 0.6mol/L HNO3恰好使混合物溶解,同時收集到2 240mL NO(標準狀況)。若將上述混合物用足量的氫氣還原,所得固體的質量為16g16g;若混合物中含有0.1mol Cu,將該混合物與稀硫酸充分反應,至少消耗硫酸的物質的量為0.1mol0.1mol。
4
m
9
4
m
9
電解
【考點】氧化銅與氧化亞銅的性質;銅鹽.
【答案】2Cu+2HI=2CuI+H2↑;Cu2O+2H+=Cu+H2O+Cu2+;3Cu2O+14H++2NO=6Cu2++2NO↑+7H2O;洗滌、干燥剩余固體后稱量,固體質量大于g;負;2Cu-2e-+2OH-=Cu2O+H2O;變大;16g;0.1mol
4
m
9
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:4引用:1難度:0.4
相似題
-
1.(1)H、B、N、Cl四種元素中不屬于p區的為
(填元素名稱),未成對電子數目最多的基態原子的電子排布式為,同周期第一電離能介于B和N之間的元素有種。
(2)最重要的含鈹礦物是綠柱石,含2%鉻(Cr)的綠柱石即為祖母綠。基態Cr原子的價層電子軌道表示式為。
(3)鈹與相鄰主族的鋁元素性質相似。下列有關鈹和鋁的敘述正確的有(填字母)。
A.都屬于p區主族元素
B.電負性都比鎂大
C.第一電離能都比鎂大
D.氯化物的水溶液pH均小于7
(4)Mn、Fe兩元素的部分電離能數據列于表:
比較Mn、Fe兩元素的I2、I3可知,氣態Mn2+再失去一個電子比氣態Fe2+再失去一個電子難。對此,你的解釋是元素 Mn Fe 電離能/(kJ?mol-1) I1 717 759 I2 1509 1561 I3 3248 2957 。
(5)高溫下CuO容易轉化為Cu2O的原因是。發布:2024/12/30 13:0:2組卷:5引用:3難度:0.5 -
2.某化學課外小組利用廢銅制取硫酸銅,設計了如下制取方案,其中從理論、操作、經濟、環保等方面考慮,你認為最合理的是( )
A.Cu CuSO4稀硫酸△B.Cu CuSO4濃硫酸△C.Cu CuOO2△CuSO4稀硫酸D.Cu Cu(NO3)2AgNO3溶液Cu( OH)2NaOH溶液CuSO4稀硫酸發布:2024/12/30 14:30:1組卷:29引用:3難度:0.7 -
3.把質量為m g的銅絲灼燒變黑后,立即放入下列物質中,銅絲變紅且質量仍為m g的是( )
A.稀硝酸 B.醋酸溶液 C.乙醇 D.CH3CHO 發布:2024/12/30 19:30:2組卷:51引用:3難度:0.9


