一定條件下,二氧化碳可合成低碳烯烴,緩解溫室效應(yīng)、充分利用碳資源。
(1)已知:①C2H4(g)+2O2(g)═2CO2(g)+2H2(g)△H1
②2H2(g)+O2(g)═2H2O(l)△H2
③H2O(l)═H2O(g)△H3
④2CO2(g)+6H2(g)催化劑C2H4(g)+4H2O(g)△H4
則△H4═ΔH4═2ΔH2+4ΔH3-ΔH1ΔH4═2ΔH2+4ΔH3-ΔH1(用△H1、△H2、△H3表示)。
(2)反應(yīng)④的反應(yīng)溫度、投料比[n(H2)n(CO2)═x]對(duì)CO2平衡轉(zhuǎn)化率的影響如圖所示:
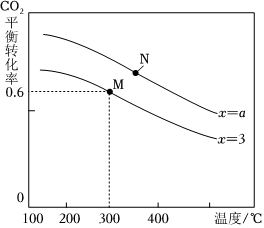
①a >>3(填“>”“<”或“═”,下同);M、N兩點(diǎn)反應(yīng)的平衡常數(shù)KM>>KN。
②300℃,往6L反應(yīng)容器中加入3molH2、1molCO2,反應(yīng)10min達(dá)到平衡。求0到10min氫氣的平均反應(yīng)速率為 0.03mol?L-1?min-10.03mol?L-1?min-1。
(3)中科院蘭州化學(xué)物理研究所用Fe3(CO)12/ZSM-5催化CO2加氫合成低碳烯烴反應(yīng),所得產(chǎn)物含CH4、C3H6、C4H8等副產(chǎn)物,反應(yīng)過程如圖:
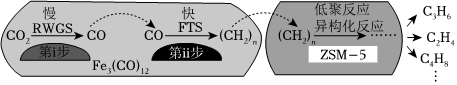
催化劑中添加Na、K、Cu助劑后(助劑也起催化作用)可改變反應(yīng)的選擇性,在其他條件相同時(shí),添加不同助劑,經(jīng)過相同時(shí)間后測(cè)得CO2轉(zhuǎn)化率和各產(chǎn)物的物質(zhì)的量分?jǐn)?shù)如表:
催化劑
n
(
H
2
)
n
(
C
O
2
)
| 助劑 | CO2轉(zhuǎn)化率(%) | 各產(chǎn)物在所有產(chǎn)物中的占比(%) | ||
| C2H4 | C3H6 | 其他 | ||
| Na | 42.5 | 35.9 | 39.6 | 24.5 |
| K | 27.2 | 75.6 | 22.8 | 1.6 |
| Cu | 9.8 | 80.7 | 12.5 | 6.8 |
K
K
助劑效果最好。②下列說法正確的是
ac
ac
(填標(biāo)號(hào))。a.第i步反應(yīng)為CO2+H2?CO+H2O
b.第i步反應(yīng)的活化能低于第ⅱ步
c.催化劑助劑生要在低聚反應(yīng)、異構(gòu)化反應(yīng)環(huán)節(jié)起作用
d.Fe3(CO)12/ZSM-5使CO2加氫合成低碳烯烴的△H減小
e.添加不同助劑后,反應(yīng)的平衡常數(shù)各不相同
(4)2018年,強(qiáng)堿性電催化還原CO2制乙烯研究取得突破進(jìn)展,原理如圖所示:
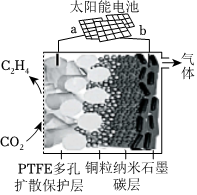
已知PTFE浸泡了飽和KCl溶液,請(qǐng)寫出陰極的電極反應(yīng):
2CO2+12e-+8H2O═C2H4+12OH-
2CO2+12e-+8H2O═C2H4+12OH-
。【答案】ΔH4═2ΔH2+4ΔH3-ΔH1;>;>;0.03mol?L-1?min-1;K;ac;2CO2+12e-+8H2O═C2H4+12OH-
【解答】
【點(diǎn)評(píng)】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:21引用:3難度:0.7
相似題
-
1.升高溫度,下列數(shù)據(jù)不一定增大的是( )
A.化學(xué)反應(yīng)速率v B.水的離子積常數(shù)Kw C.化學(xué)平衡常數(shù)K D.氨水的電離平衡常數(shù)Ka 發(fā)布:2025/1/6 6:0:5組卷:31引用:4難度:0.7 -
2.催化還原CO2是解決溫室效應(yīng)及能源問題的重要手段之一。研究表明,在Cu/ZnO催化劑存在下,CO2和H2可發(fā)生以下兩個(gè)平衡反應(yīng)。下列有關(guān)說法不正確的是( )
①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ?mol-1
②CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41.2kJ?mol-1A.反應(yīng)①為放熱反應(yīng),反應(yīng)②為吸熱反應(yīng) B.使用不同催化劑,會(huì)改變反應(yīng)①②的△H C.反應(yīng)CO(g)+2H2(g)?CH3OH(g)的△H3=-94.9kJ?mol-1 D.投料比不變,增加反應(yīng)物的濃度可提高CO2轉(zhuǎn)化為CH3OH平衡轉(zhuǎn)化率 發(fā)布:2025/1/6 6:0:5組卷:90引用:3難度:0.5 -
3.現(xiàn)代工業(yè)將煤汽化,既可以提高燃料的利用率、減少CO、SO2等的排放,又可以擴(kuò)大水煤氣的用途.甲醇是一種可再生能源,具有開發(fā)和應(yīng)用的廣闊前景,工業(yè)上一般可采用水煤氣來(lái)合成甲醇CO(g)+2H2(g)?CH3OH(g).
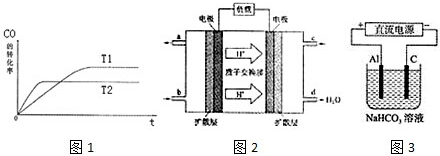
(1)如圖1是該反應(yīng)在不同溫度下CO的轉(zhuǎn)化率隨時(shí)間變化的曲線.
①T1和T2溫度下的平衡常數(shù)大小關(guān)系是K1K2(填“>”、“<”或“=”).
②以下有關(guān)說法正確的是
a.恒溫、恒容條件下,容器內(nèi)的壓強(qiáng)不發(fā)生變化則可逆反應(yīng)達(dá)到平衡
b.一定條件下,H2的消耗速率是CO的消耗速率的2倍時(shí)可逆反應(yīng)達(dá)到平衡
c.使用合適的催化劑能縮短達(dá)到平衡的時(shí)間并提高CH3OH的產(chǎn)率
d.某溫度下,將2molCO和6molH2充入2L的密閉容器中,充分反應(yīng),達(dá)到平衡后,測(cè)得c(CO)=0.2mol/L,則CO的轉(zhuǎn)化率為80%
(2)已知在常溫常壓下①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H=-akJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-bkJ?mol-1③H2O(g)=H2O(1)△H=-ckJ?mol-1
則:CH3OH(1)+O2(g)=CO(g)+2H2O(1)△H=kJ?mol-1
(3)2009年10月,中國(guó)科學(xué)院長(zhǎng)春應(yīng)用化學(xué)研究所在甲醇燃料電池技術(shù)方面獲得新突破,組裝出了自呼吸電池及主動(dòng)式電堆.甲醇燃料電池的工作原理如圖2所示.
①該電池正極的電極反應(yīng)式為.
②工作一段時(shí)間后,當(dāng)6.4g甲醇完全反應(yīng)生成CO2時(shí),有個(gè)電子發(fā)生轉(zhuǎn)移.
(4)以上述電池做電源,用圖3所示裝置,在實(shí)驗(yàn)室中模擬鋁制品面“鈍化”處理的過程中,發(fā)現(xiàn)溶液逐漸變渾濁,原因是、(用相關(guān)的電極反應(yīng)式和離子方程式表示)發(fā)布:2024/12/30 14:0:1組卷:26引用:3難度:0.5
相關(guān)試卷


