制燒堿所用鹽水需兩次精制.第一次精制主要是用沉淀法除去粗鹽水中Ca2+、Mg2+、Fe3+、SO42-等離子,過程如下:
Ⅰ.向粗鹽水中加入過量BaCl2溶液,過濾;
Ⅱ.向所得濾液中加入過量Na2CO3溶液,過濾;
Ⅲ.濾液用鹽酸調節(jié)pH,獲得一次精制鹽水.
(1)過程Ⅰ除去的離子是SO42-SO42-.
(2)過程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
取少量過程II后的濾液于試管中,滴加幾滴KSCN溶液,若溶液不變紅,說明Fe3+已除盡;反之沒除盡
取少量過程II后的濾液于試管中,滴加幾滴KSCN溶液,若溶液不變紅,說明Fe3+已除盡;反之沒除盡
.②過程Ⅰ選用BaCl2而不選用CaCl2,運用表中數據解釋原因
BaSO4的溶解度比CaSO4的小,可將SO42-沉淀更完
BaSO4的溶解度比CaSO4的小,可將SO42-沉淀更完
.③除去Mg2+的離子方程式是
2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑
2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑
.④檢測Ca2+、Mg2+、Ba2+是否除盡時,只需檢測Ba2+即可,原因是
在BaCO3、CaCO3、Mg2(OH)2CO3中,BaCO3的溶解度最大,若Ba2+沉淀完全,則說明Mg2+和Ca2+也沉淀完全
在BaCO3、CaCO3、Mg2(OH)2CO3中,BaCO3的溶解度最大,若Ba2+沉淀完全,則說明Mg2+和Ca2+也沉淀完全
.(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如圖:
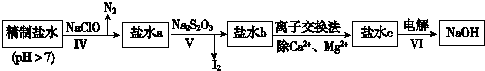
①過程Ⅳ除去的離子是
NH4+、I-
NH4+、I-
.②鹽水b中含有SO42-.Na2S2O3將IO3-還原為I2的離子方程式是
5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O
5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O
.③過程Ⅵ中,在電解槽的陰極區(qū)生成NaOH,結合化學平衡原理解釋:
H+在陰極上得電子變成H2逸出,使H2O?H++OH-電離平衡向右移動,OH-在陰極區(qū)濃度增大,Na+向陰極區(qū)移動,最后NaOH在陰極區(qū)生成
H+在陰極上得電子變成H2逸出,使H2O?H++OH-電離平衡向右移動,OH-在陰極區(qū)濃度增大,Na+向陰極區(qū)移動,最后NaOH在陰極區(qū)生成
.【答案】SO42-;取少量過程II后的濾液于試管中,滴加幾滴KSCN溶液,若溶液不變紅,說明Fe3+已除盡;反之沒除盡;BaSO4的溶解度比CaSO4的小,可將SO42-沉淀更完;2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑;在BaCO3、CaCO3、Mg2(OH)2CO3中,BaCO3的溶解度最大,若Ba2+沉淀完全,則說明Mg2+和Ca2+也沉淀完全;NH4+、I-;5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O;H+在陰極上得電子變成H2逸出,使H2O?H++OH-電離平衡向右移動,OH-在陰極區(qū)濃度增大,Na+向陰極區(qū)移動,最后NaOH在陰極區(qū)生成
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網所有,未經書面同意,不得復制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:142引用:5難度:0.1
相似題
-
1.為了除去KCl溶液中少量的MgCl2、MgSO4雜質,可選用Ba(OH)2溶液、稀鹽酸和K2CO3溶液三種試劑,按圖步驟操作:
溶液加過量A濾液加過量B操作Ⅰ加過量C較純凈的KCl溶液加熱煮沸
(1)寫出下列試劑的化學式:A,C
(2)根據題意,回答下列問題:
①加入過量A的目的是,
②加入過量B的目的是,
③加熱煮沸的目的是,
(3)操作Ⅰ的名稱是。發(fā)布:2024/12/14 8:0:2組卷:53引用:1難度:0.6 -
2.除去粗鹽中的雜質 CaCl2、MgCl2和 Na2SO4,過程如下:

下列有關說法中,不正確的是( )A.除去 Mg2+的主要反應:MgCl2+2NaOH-=Mg(OH)2↓+2NaCl B.試劑①一定不是Na2CO3溶液 C.檢驗 是否除凈:取少量濾液,加稀鹽酸酸化,再加 BaCl2溶液SO2-4D.濾液加稀鹽酸時只發(fā)生反應:HCl+NaOH=H2O+NaCl 發(fā)布:2024/12/30 4:0:1組卷:123引用:11難度:0.8 -
3.通過海水晾曬可得粗鹽,粗鹽除NaCl外,還含有MgCl2、CaCl2、Na2SO4以及泥沙等雜質,粗鹽精制的實驗流程如下。下列說法不正確的是( )
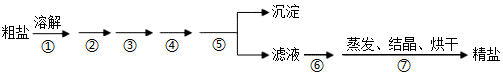
A.在第①步中使用玻璃棒攪拌可加速粗鹽溶解 B.第⑤步操作是過濾 C.在第②③④⑥步通過加入化學試劑除雜,加入試劑順序為:NaOH溶液→Na2CO3溶液→BaCl2溶液→稀鹽酸 D.除去MgCl2的離子方程式為:Mg2++2OH-=Mg(OH)2↓ 發(fā)布:2024/12/30 4:30:1組卷:91引用:5難度:0.8


