探究Na2SO3固體的熱分解產物。
資料:①4Na2SO3 △ Na2S+3Na2SO4.。
②Na2S能與S反應生成Na2Sx,Na2Sx與酸反應生成S和H2S。
③BaS易溶于水。
隔絕空氣條件下,加熱無水Na2SO3固體得到黃色固體A,過程中未檢測到氣體生成。黃色固體A加水得到濁液,放置得無色溶液B。
(1)檢驗分解產物Na2S
取少量溶液B,向其中滴加CuSO4溶液,產生黑色沉淀,證實有S2-.反應的離子方程式是 S2-+Cu2+=CuS↓S2-+Cu2+=CuS↓。
(2)檢驗分解產物Na2SO4
取少量溶液B,滴加BaCl2溶液,產生白色沉淀,加入鹽酸,沉淀增多(經檢驗該沉淀含S),同時產生有臭雞蛋氣味的氣體(H2S),由于沉淀增多對檢驗造成干擾,另取少量溶液B,加入足量鹽酸,離心沉降(固液分離)后,滴加BaCl2溶液,產生白色沉淀滴加BaCl2溶液,產生白色沉淀(填操作和現象),可證實分解產物中含有SO42-。
(3)探究(2)中S的來源
來源1:固體A中有未分解的Na2SO3,在酸性條件下與Na2S反應生成S。
來源2:溶液B中有Na2Sx,加酸反應生成S。
針對來源1進行如下實驗:
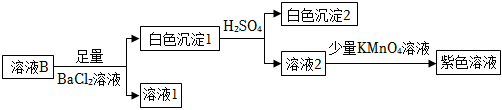
①實驗可證實來源1不成立。實驗證據是 向溶液2中加入KMnO4溶液,溶液沒有褪色向溶液2中加入KMnO4溶液,溶液沒有褪色。
②不能用鹽酸代替硫酸的原因是 鹽酸中Cl元素為-1價,是Cl元素的最低價,具有還原性,會與KMnO4溶液發生氧化還原反應,使KMnO4溶液應該褪色,干擾實驗現象和實驗結論鹽酸中Cl元素為-1價,是Cl元素的最低價,具有還原性,會與KMnO4溶液發生氧化還原反應,使KMnO4溶液應該褪色,干擾實驗現象和實驗結論。
③寫出來源2產生S的反應的離子方程式:Sx2-+2H+=H2S↑+(x-1)S↓Sx2-+2H+=H2S↑+(x-1)S↓。
(4)實驗證明Na2SO3固體熱分解有Na2S、Na2SO4和S產生。運用氧化還原反應規律分析產物中S產生的合理性:根據反應4Na2SO3 △ Na2S+3Na2SO4可知,Na2SO3發生歧化反應,其中的S元素化合價即可升高也可降低,能從+4價降為-2價,也應該可以降到0價生成硫單質根據反應4Na2SO3 △ Na2S+3Na2SO4可知,Na2SO3發生歧化反應,其中的S元素化合價即可升高也可降低,能從+4價降為-2價,也應該可以降到0價生成硫單質。
△
△
△
【答案】S2-+Cu2+=CuS↓;滴加BaCl2溶液,產生白色沉淀;向溶液2中加入KMnO4溶液,溶液沒有褪色;鹽酸中Cl元素為-1價,是Cl元素的最低價,具有還原性,會與KMnO4溶液發生氧化還原反應,使KMnO4溶液應該褪色,干擾實驗現象和實驗結論;Sx2-+2H+=H2S↑+(x-1)S↓;根據反應4Na2SO3 Na2S+3Na2SO4可知,Na2SO3發生歧化反應,其中的S元素化合價即可升高也可降低,能從+4價降為-2價,也應該可以降到0價生成硫單質
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:1018引用:13難度:0.5
相似題
-
1.下列說法不正確的是( )
A.硫是一種淡黃色能溶于水的固體 B.硫的化合物常存在于火山噴出的氣體中和礦泉水里 C.硫是黑火藥的主要成分 D.一些動、植物體內也含有硫元素 發布:2024/12/30 15:0:1組卷:11引用:2難度:0.8 -
 2.硫俗稱硫黃,主要存在于火山口附近或地殼的巖層中(如圖),是一種黃色晶體,質脆易研成粉末,熔點為113℃,沸點為445℃,密度為2.06g/cm3。硫黃難溶于水,微溶于酒精、醚,易溶于二硫化碳。作為易燃固體,硫黃主要用于制造染料、農藥、火柴、火藥等。硫黃雖然是低毒性物質,但其燃燒后的氣體對人體有致命的危害。
2.硫俗稱硫黃,主要存在于火山口附近或地殼的巖層中(如圖),是一種黃色晶體,質脆易研成粉末,熔點為113℃,沸點為445℃,密度為2.06g/cm3。硫黃難溶于水,微溶于酒精、醚,易溶于二硫化碳。作為易燃固體,硫黃主要用于制造染料、農藥、火柴、火藥等。硫黃雖然是低毒性物質,但其燃燒后的氣體對人體有致命的危害。
(1)指出硫元素在元素周期表中的位置,硫元素的最高正價與最低負價分別是多少。
(2)從硫元素價態變化的角度分析,單質硫有哪些化學性質。
(3)如何用化學方法清洗試管內壁上附著的硫黃。寫出反應的離子方程式。發布:2024/12/30 15:0:1組卷:6引用:2難度:0.7 -
3.下列說法正確的是( )
A.S在過量的O2中充分燃燒,可得SO3 B.單質硫難溶于水,易溶于酒精和二硫化碳 C.鐵與過量單質硫加熱時反應生成Fe2S3 D.硫在O2中燃燒發出明亮的藍紫色火焰產生無色有刺激性氣味的氣體 發布:2024/12/30 15:0:1組卷:4引用:2難度:0.8


