我國化工專家侯德榜,改進氨堿法設計了“聯合制堿法”,為世界制堿工業作出了突出貢獻。生產流程如圖1: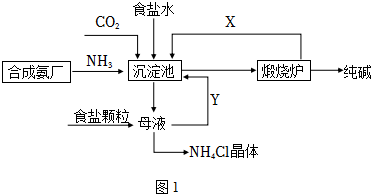
(1)完成有關反應的化學方程式
①沉淀池:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4ClNH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;
②煅燒爐:2NaHCO3 △ Na2CO3+CO2↑+H2O2NaHCO3 △ Na2CO3+CO2↑+H2O。
(2)聯合制堿法的優點表述中,錯誤的是 CC。
A.生產原料為:食鹽、NH3、CO2
B.副產物氯化銨可做氮肥
C.生產過程中可循環利用的物質只有CO2
D.原料利用率高
某實驗小組,利用下列裝置圖2模擬“聯合制堿法”的第一步反應。
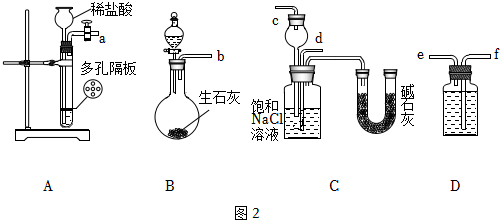
(3)上述裝置中接口連接順序為 DD。
A.a接c;b接f、e接d
B.a接d;b接f、e接c
C.b接d;a接e、f接c
D.b接c;a接f、e接d
(4)D中應選用的液體為 飽和NaHCO3溶液飽和NaHCO3溶液。
為測定產品純堿的成分和含量,做如下實驗.假設產品純堿中只含NaCl、NaHCO3雜質:
(5)檢驗產品純堿中是否含有NaCl,可取少量試樣溶于水后,再滴加試劑,確定沉淀已經完全的操作是:稀HNO3和AgNO3溶液稀HNO3和AgNO3溶液。
(6)滴定法測定純堿產品中NaHCO3含量的方法是:準確稱取純堿樣品Wg,放入錐形瓶中加蒸餾水溶解,加1~2滴酚酞指示劑,用cmol/L的HCl溶液滴定至溶液由紅色變為無色(指示CO2-3+H+→HCO-3反應的終點),所用HCl溶液體積為V1mL,再加1~2滴甲基橙指示劑,繼續用HCl溶液滴定至溶液由黃色變為橙色,所用HCl溶液總體積為V2mL。則純堿樣品中NaHCO3質量分數為 c(V2-V1)×841000W×100%c(V2-V1)×841000W×100%。(用含V1、V2、c、W的代數式表示)
△
△
CO
2
-
3
HCO
-
3
c
(
V
2
-
V
1
)
×
84
1000
W
c
(
V
2
-
V
1
)
×
84
1000
W
【考點】純堿工業(侯氏制堿法);連接儀器裝置.
【答案】NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;2NaHCO3 Na2CO3+CO2↑+H2O;C;D;飽和NaHCO3溶液;稀HNO3和AgNO3溶液;×100%
△
c
(
V
2
-
V
1
)
×
84
1000
W
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:57引用:1難度:0.7
相似題
-
1.以NaCl為原料,可制取純堿。Na2CO3可用侯氏制堿法制取,主要涉及如下反應:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3
Na2CO3+CO2↑+H2O,下列有關實驗室模擬侯氏制堿法的實驗原理和裝置正確的是( )△
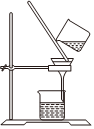
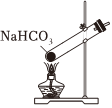
A.制取CO2 B.制取NaHCO3 C.分離NaHCO3 D.制取Na2CO3 A.A B.B C.C D.D 發布:2024/12/8 18:0:1組卷:164引用:5難度:0.8 -
2.“侯氏制堿法”的主要過程如圖(部分物質已略去)。
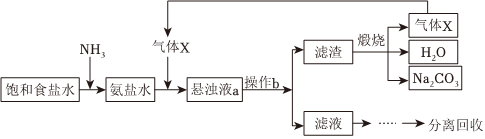
下列說法錯誤的是( )A.氣體X為CO2 B.操作b為過濾 C.懸濁液a中的不溶物主要是NH4Cl D.氨鹽水中通入氣體X后,溶液中Na+大量減少 發布:2024/12/8 0:0:1組卷:132引用:4難度:0.7 -
3.氨堿法(索氏)和聯合制堿法(侯氏)是兩大重要的工業制堿法,下列表達正確的是( )
氨堿法 聯合制堿法 A 原料 食鹽、氨氣、生石灰 食鹽、氨氣、二氧化碳 B 副產物 氯化鈣 氯化銨 C 循環物質 氨氣、二氧化碳 氯化鈉 D 評價 原料易得、設備簡單、能耗低 原料利用率高、廢棄物少 A.A B.B C.C D.D 發布:2024/12/16 6:0:1組卷:38引用:2難度:0.8


