SO2、NOx是主要的空氣污染源,需要經過處理才能排放。回答下列問題:
(1)二氧化硫在V2O5作用下的催化氧化是工業上生產硫酸的主要反應。熱化學方程式為2SO2(g)+O2(g)?2SO3(g)△H=-a kJ?mol-1。催化反應的機理是(填寫第二步熱化學方程式):
第一步:SO2(g)+V2O5(s)═SO3(g)+V2O4(s)△H=+b kJ?mol-1
第二步:V2O4(s)+2SO2(g)+O2(g)═2VOSO4(s)△H=-3a-2b+c2kJ/molV2O4(s)+2SO2(g)+O2(g)═2VOSO4(s)△H=-3a-2b+c2kJ/mol。
第三步:4VOSO4(s)+O2(g)═2V2O5(s)+4SO3(g)△H=-c kJ?mol-1
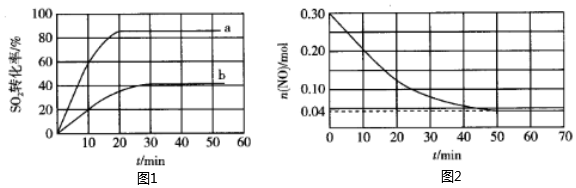
(2)一定條件下,用Fe2O3作催化劑對燃煤煙氣進行回收。反應為2CO(g)+SO2(g)催化劑2CO2(g)+S(l)△H<0。80℃時,在容積恒為1L的密閉容器中投入總物質的量為2mol的氣體,按n(CO):n(SO2)為1:1、3:1投料時SO2轉化率的變化情況如圖。則圖中表示n(CO):n(SO2)=1:1的變化曲線為 bb(填字母);若曲線bSO2的平衡轉化率是42%,用SO2表示30min內的平均反應速率是 0.014mol/(L?min)0.014mol/(L?min)。
(3)一定溫度下,在容積恒為1L的密閉容器中,充入0.30molNO與過量的金屬Al,發生的反應存在如下平衡:43Al(s)+2NO(g)?N2(g)+23Al2O3(s)△H<0。已知在此條件下NO與N2的消耗速率與各自的濃度有如下關系(k1、k2為速率常數):v(NO)=k1?c2(NO),v(N2)=k2?c(N2)。
①在T1溫度下,k1=0.004L?mol-1?min-1,k2=0.002min-1,該溫度下反應的平衡常數的值為 1L/mol1L/mol。
②T2溫度下,NO的物質的量隨時間的變化如圖,其平衡常數的值為 81.25L/mol81.25L/mol;溫度T1大于大于T2(填“小于”、“等于”或“大于”),判斷理由是 溫度為T2時的平衡常數比溫度為T1時的大,此反應為放熱反應,升高溫度平衡向逆反應方向移動,得T1大于T2溫度為T2時的平衡常數比溫度為T1時的大,此反應為放熱反應,升高溫度平衡向逆反應方向移動,得T1大于T2。
-
3
a
-
2
b
+
c
2
-
3
a
-
2
b
+
c
2
催化劑
4
3
2
3
【答案】V2O4(s)+2SO2(g)+O2(g)═2VOSO4(s)△H=kJ/mol;b;0.014mol/(L?min);1L/mol;81.25L/mol;大于;溫度為T2時的平衡常數比溫度為T1時的大,此反應為放熱反應,升高溫度平衡向逆反應方向移動,得T1大于T2
-
3
a
-
2
b
+
c
2
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:31引用:2難度:0.4
相似題
-
1.氫氣最早于16世紀被人工制取出來,氫氣是一種清潔能源。
(1)利用光伏電池電解水制H2是氫能的重要來源。已知:H-H鍵、O=O鍵、H-O鍵的鍵能依次為436kJ?mol-1、495kJ?mol-1、463kJ?mol-1。則2H2O(g)═2H2(g)+O2(g)△H=kJ?mol-1。
(2)T1℃時,向5L恒容密閉容器中充入0.5molCH4,只發生反應2CH4(g)?C2H4(g)+2H2(g),達到平衡時,測得c(C2H4)=2c(CH4),CH4的轉化率為;保持其他條件不變,溫度改為T2℃,經25s后達到平衡,測得c(CH4)=2c(C2H4),則0~25s內v(C2H4)=mol?L-1?s-1。
(3)CH4分解時幾種氣體的平衡分壓(pPa)的對數值lgp與溫度的關系如圖所示。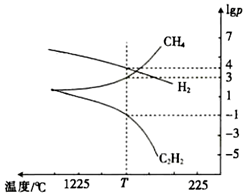
①T℃時,向一恒容密閉容器中通入一定量的CH4(g)、C2H4(g)和H2(g),只發生反應2CH4(g)?C2H2(g)+3H2(g)ΔH,ΔH(填“>”或“<”)0,此時的平衡常數Kp=(用平衡分壓代替濃度進行計算)Pa2。
②若只改變一個反應條件使Kp變大,則該條件是(填標號)。
A.減小C2H2的濃度
B.升高溫度
C.增大壓強
D.加入合適的催化劑
(4)工業上,以KNH2和液氨為電解質,以石墨為電極,電解液氨制備H2。陽極的電極反應式為,一段時間后陰、陽兩極收集到的氣體質量之比為。發布:2025/1/4 8:0:1組卷:9引用:3難度:0.5 -
2.反應 4A(g)+5B(g)?4C(g)+6D(g)在 5L 的密閉容器中進行,半分鐘后,C 的物質的量增 加了 0.30mol。下列敘述正確的是( )
A.容器中 D 的物質的量至少為 0.45 mol B.A 的平均反應速率是 0.010 mol?L-1?s-1 C.容器中 A、B、C、D 的物質的量之比一定是 4:5:4:6 D.容器中 A 的物質的量一定增加了 0.30 mol 發布:2024/12/30 19:30:2組卷:67引用:6難度:0.6 -
3.將等物質的量的A、B混合于2L的密閉容器中,發生如下反應:3A(g)+B(g)?xC(g)+2D(g),經5min后,測得D的濃度為0.5mol/L,c(A):c(B)=3:5,C的平均反應速率為0.1mol/(L?min).求:
(1)此時A的濃度c(A)=mol/L,反應開始前容器中的A、B的物質的量:n(A)=n(B)=mol;
(2)B的平均反應速率v(B)=mol/(L?min);
(3)x的值為.發布:2024/12/30 19:0:1組卷:163引用:26難度:0.3
相關試卷


