根據侯德榜提出的工藝,制堿廠設計生產流程如下:
(1)該流程中可循環利用的物質是CO2、NaClCO2、NaCl.向母液中通氨氣,并加入細小食鹽顆粒,冷卻析出副產品,通氨氣的作用有ACAC.

A.增大NH4+的濃度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3轉化為Na2CO3,提高析出的NH4Cl純度
(2)檢驗產品純堿中是否含有NaCl的試劑是稀HNO3和AgNO3溶液稀HNO3和AgNO3溶液.
(3)某學習小組在實驗室模擬制堿有關工藝.
①若利用氯化銨和熟石灰制取氨氣,反應方程式是2NH4Cl+Ca(OH)2 △ CaCl2+2NH3↑+2H2O2NH4Cl+Ca(OH)2 △ CaCl2+2NH3↑+2H2O,制得的氨氣可用下列盛有NaCl溶液的bb裝置吸收.

②已知用飽和NaNO2與NH4Cl溶液加熱可制取氮氣.該小組模擬工業合成氨設計如下裝置:

儀器a的名稱是蒸餾燒瓶蒸餾燒瓶;氫氣的發生裝置應選用BB;A裝置加熱片刻后,即應移去酒精燈以防反應物沖出,其原因是因本反應放熱,不需持續加熱因本反應放熱,不需持續加熱.裝置D的作用是①除去N2、H2中的水;②使N2、H2混合均勻使N2、H2混合均勻;③觀察并調節氣泡速率,控制N2、H2的比例.
有同學認為:從氨合成器(E裝置)中出來的氣體連續通入F裝置的NaCl溶液中,可能會發生倒吸.你認為是否可能并說明理由.否,該反應生成的氨氣中含有大量難溶于水的N2和H2,氨氣溶于水氣壓降低不是很大否,該反應生成的氨氣中含有大量難溶于水的N2和H2,氨氣溶于水氣壓降低不是很大.
△
△
【考點】純堿工業(侯氏制堿法).
【答案】CO2、NaCl;AC;稀HNO3和AgNO3溶液;2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O;b;蒸餾燒瓶;B;因本反應放熱,不需持續加熱;使N2、H2混合均勻;否,該反應生成的氨氣中含有大量難溶于水的N2和H2,氨氣溶于水氣壓降低不是很大
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:44引用:2難度:0.5
相似題
-
1.以NaCl為原料,可制取純堿。Na2CO3可用侯氏制堿法制取,主要涉及如下反應:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;2NaHCO3
Na2CO3+CO2↑+H2O,下列有關實驗室模擬侯氏制堿法的實驗原理和裝置正確的是( )△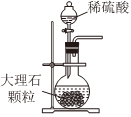
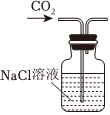
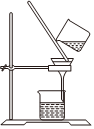
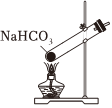
A.制取CO2 B.制取NaHCO3 C.分離NaHCO3 D.制取Na2CO3 A.A B.B C.C D.D 發布:2024/12/8 18:0:1組卷:169引用:5難度:0.8 -
2.“侯氏制堿法”的主要過程如圖(部分物質已略去)。
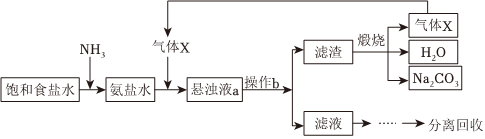
下列說法錯誤的是( )A.氣體X為CO2 B.操作b為過濾 C.懸濁液a中的不溶物主要是NH4Cl D.氨鹽水中通入氣體X后,溶液中Na+大量減少 發布:2024/12/8 0:0:1組卷:135引用:4難度:0.7 -
3.氨堿法(索氏)和聯合制堿法(侯氏)是兩大重要的工業制堿法,下列表達正確的是( )
氨堿法 聯合制堿法 A 原料 食鹽、氨氣、生石灰 食鹽、氨氣、二氧化碳 B 副產物 氯化鈣 氯化銨 C 循環物質 氨氣、二氧化碳 氯化鈉 D 評價 原料易得、設備簡單、能耗低 原料利用率高、廢棄物少 A.A B.B C.C D.D 發布:2024/12/16 6:0:1組卷:38引用:2難度:0.8


