為探索穩(wěn)定性ClO2溶液對氮氧化物(NOx)的處理效果,實驗過程如下:
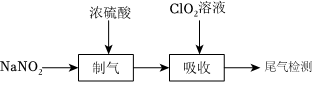
已知:ClO2具有強氧化性,且氧化性隨著溶液的酸性增強而增強。ClO2和NaOH反應的化學方程式為:2ClO2+2NaOH═NaClO2+NaClO3+H2O。NaClO2對氮氧化物具有強吸收效果。
(1)“制氣”階段生成NaHSO4、NO和NO2。“制氣”反應的化學方程式為 2NaNO2+2H2SO4(濃)=2NaHSO4+NO↑+NO2↑+H2O2NaNO2+2H2SO4(濃)=2NaHSO4+NO↑+NO2↑+H2O。
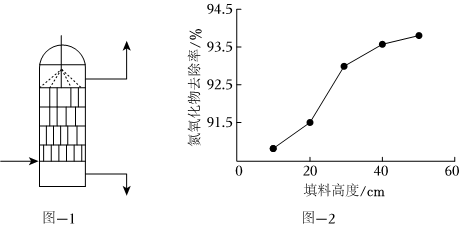
(2)ClO2可以將NO氧化為NO2,并進一步將NO2氧化為HNO3,ClO2則被還原為Cl-。吸收時,ClO2溶液從吸收器頂部噴淋,氮氧化物從吸收器底部通入(如圖-1所示)。NOx的吸收率與吸收器內(nèi)碎瓷片填料的高度關系如圖-2所示。
①NO2和ClO2反應的離子方程式為 5NO2+3H2O+ClO2=5NO-3+6H++Cl-5NO2+3H2O+ClO2=5NO-3+6H++Cl-。
②隨著吸收器內(nèi)填料高度增加,NOx去除率增高的原因是 填料高度增加,使氣體和吸收液能夠充分接觸反應填料高度增加,使氣體和吸收液能夠充分接觸反應。
(3)通過加入鹽酸或NaOH調(diào)節(jié)ClO2溶液的pH,測得不同pH的ClO2溶液對NOx吸收率的影響如圖3所示。
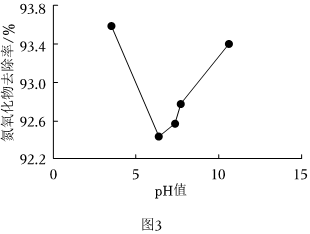
①當pH小于7時,NOx吸收率隨pH增大而減小的原因是 當pH<7時,ClO2的氧化性隨pH增大而減弱,氧化氮氧化物的能力下降當pH<7時,ClO2的氧化性隨pH增大而減弱,氧化氮氧化物的能力下降。
②當pH大于7時,NOx吸收率隨pH增大而增大的原因是 當pH>7時,隨著pH增大,ClO2轉(zhuǎn)化為NaClO2和NaClO3的程度增大,NaClO2濃度增大,由于NaClO2對氮氧化物具有強吸收能力,導致吸收液對氮氧化物的吸收效率增高當pH>7時,隨著pH增大,ClO2轉(zhuǎn)化為NaClO2和NaClO3的程度增大,NaClO2濃度增大,由于NaClO2對氮氧化物具有強吸收能力,導致吸收液對氮氧化物的吸收效率增高。
NO
-
3
NO
-
3
【答案】2NaNO2+2H2SO4(濃)=2NaHSO4+NO↑+NO2↑+H2O;5NO2+3H2O+ClO2=5+6H++Cl-;填料高度增加,使氣體和吸收液能夠充分接觸反應;當pH<7時,ClO2的氧化性隨pH增大而減弱,氧化氮氧化物的能力下降;當pH>7時,隨著pH增大,ClO2轉(zhuǎn)化為NaClO2和NaClO3的程度增大,NaClO2濃度增大,由于NaClO2對氮氧化物具有強吸收能力,導致吸收液對氮氧化物的吸收效率增高
NO
-
3
【解答】
【點評】
聲明:本試題解析著作權屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:82引用:3難度:0.6
相似題
-
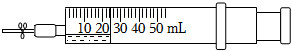 1.如圖所示,在一支50mL的注射器里充入20mL NO,然后吸入5mL水,用乳膠管和彈簧夾封住管口。
1.如圖所示,在一支50mL的注射器里充入20mL NO,然后吸入5mL水,用乳膠管和彈簧夾封住管口。
(1)根據(jù)操作步驟,完成表格:
(2)如果要將注射器中的NO充分轉(zhuǎn)化,可以采取什么措施?操作步驟河 實驗現(xiàn)象 解釋原因 Ⅰ.振蕩注射器,觀察現(xiàn)象 無明顯現(xiàn)象 ① Ⅱ.打開彈簧夾,快速吸入10mL空氣后夾上彈簧夾,觀察現(xiàn)象 ② ③ Ⅲ.振蕩注射器,再觀察現(xiàn)象 氣體又變?yōu)闊o色,注射器的活塞向內(nèi)移動 ④ 。
(3)上述實驗對工業(yè)上生產(chǎn)硝酸有什么啟示?。發(fā)布:2024/12/30 6:30:2組卷:9引用:3難度:0.6 -
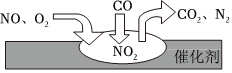 2.隨著我國汽車年銷量的大幅增加,空氣環(huán)境受到了很大的污染。汽車尾氣凈化裝置里,氣體在催化劑表面吸附與解吸作用的過程如圖所示,下列說法正確的是( )
2.隨著我國汽車年銷量的大幅增加,空氣環(huán)境受到了很大的污染。汽車尾氣凈化裝置里,氣體在催化劑表面吸附與解吸作用的過程如圖所示,下列說法正確的是( )A.該轉(zhuǎn)化過程中N元素化合價降低,C元素化合價升高,共兩種元素化合價發(fā)生變化 B.汽車尾氣的主要污染成分包括CO、NO和N2 C.NO和O2必須在催化劑表面才能反應 D.催化轉(zhuǎn)化的總化學方程式為2NO+O2+4CO 4CO2+N2催化劑發(fā)布:2024/12/30 6:30:2組卷:9引用:2難度:0.6 -
3.下列有關NO2的敘述正確的是( )
A.閃電時,空氣中的N2和O2可直接化合生成NO2 B.NO2與水反應時,NO2作還原劑,水作氧化劑 C.NO2、NO都是大氣污染氣體,在空氣中都能穩(wěn)定存在 D.NO2是紅棕色有毒氣體 發(fā)布:2024/12/30 6:30:2組卷:7引用:2難度:0.7


