將過量的氨水加到硫酸銅溶液中,溶液最終變成深藍色。
(1)Cu的價電子軌道表達式為 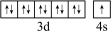
 ;在周期表中,Cu元素屬于 dsds區。
;在周期表中,Cu元素屬于 dsds區。
(2)將氨水逐滴加入硫酸銅溶液中,先生成藍色沉淀,繼續滴加氨水,沉淀溶解,寫出沉淀溶解的離子方程式:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-。
(3)向深藍色溶液繼續加入 乙醇乙醇,析出深藍色的晶體[Cu(NH3)4]SO4?H2O。[Cu(NH3)4]SO4?H2O中,1mol[Cu(NH3)4] 2+含有σ鍵的數目為 16NA16NA。
(4)NH3NH3(填“H2O”或“NH3”)與Cu2+形成的配位鍵更穩定。
(5)SO42-的VSEPR模型名稱為 正四面體正四面體,H3O+空間構型為 三角錐三角錐。
(6)硫酸銅溶液中滴入氨基乙酸鈉(H2NCH2COONa)即可得到配合物A,其結構如圖所示。
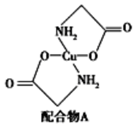
該結構中,除共價鍵外還存在配位鍵,請在圖中用“→”表示出配位鍵 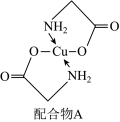
 。
。




【考點】判斷簡單分子或離子的構型;配合物的形成與組成.
【答案】 ;ds;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;乙醇;16NA;NH3;正四面體;三角錐;
;ds;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;乙醇;16NA;NH3;正四面體;三角錐;
 ;ds;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;乙醇;16NA;NH3;正四面體;三角錐;
;ds;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;乙醇;16NA;NH3;正四面體;三角錐;
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:12引用:2難度:0.7
相似題
-
1.根據VSEPR模型和雜化軌道理論對磷酸根(
)的空間結構的預測和解釋中,完全正確的是( )PO3-4A.磷酸根離子的空間結構為三角錐形 B.中心原子P的價層電子對數為4 C.中心原子P的雜化軌道類型為sp3 D.中心原子P的孤電子對數為1 發布:2025/1/5 8:0:1組卷:6引用:1難度:0.8 -
2.根據雜化軌道理論和價層電子對互斥模型判斷,下列說法不正確的是( )
選項 粒子 中心原子雜化方式 VSEPR模型 空間結構 A CO2 sp 直線形 直線形 B NH3 sp3 四面體形 三角錐形 C CO2-3sp2 四面體形 平面三角形 D H3O+ sp3 四面體形 三角錐形 A.A B.B C.C D.D 發布:2025/1/5 8:0:1組卷:78引用:3難度:0.6 -
3.通常把原子總數和價電子總數相同的分子或離子稱為等電子體。人們發現等電子體的空間結構相同,則下列有關說法中正確的是( )
A.CH4和NH4+是等電子體,鍵角均為60° B.H3O+和PCl3是等電子體,均為平面三角形結構 C.NO3-和CO32-是等電子體,均為三角錐形結構 D.B3N3H6和苯是等電子體,B3N3H6分子中存在“肩并肩”式重疊的軌道 發布:2024/12/30 18:0:1組卷:12引用:2難度:0.8


