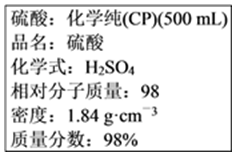
 硫酸試劑瓶標簽上的內容:
硫酸試劑瓶標簽上的內容:
計算:
(1)該硫酸的物質的量濃度是18.418.4mol?L-1。
(2)某化學興趣小組進行硫酸性質的實驗探究時,需要90 mL 4.6 mol?L-1的稀硫酸,則配制稀硫酸時需要取2525mL的該硫酸;配制時需選用的儀器主要有量筒、燒杯、玻璃棒、100mL容量瓶100mL容量瓶、膠頭滴管膠頭滴管(在橫線上填寫所缺儀器的名稱)。其中配制稀硫酸溶液時定容的操作為將蒸餾水注入容量瓶,液面離容量瓶頸刻度線下1~2cm時,改用膠頭滴管滴加蒸餾水至液面與刻度線相切將蒸餾水注入容量瓶,液面離容量瓶頸刻度線下1~2cm時,改用膠頭滴管滴加蒸餾水至液面與刻度線相切。
(3)該硫酸與等質量的水混合后所得溶液中溶質的物質的量濃度小于小于9.2 mol?L-1.(填大于或等于或小于)
(4)配制過程中,下列操作會使配制的稀硫酸溶液濃度偏高的是①③⑤①③⑤(填序號)。
①量取濃硫酸的量筒用蒸餾水洗滌2~3次,并把洗滌液轉入容量瓶
②容量瓶使用時未干燥
③溶解后未經冷卻就移液并定容
④定容時不小心有少量蒸餾水滴到瓶外
⑤用量筒量取濃硫酸時仰視讀數
【考點】物質的量濃度的相關計算;配制一定物質的量濃度的溶液.
【答案】18.4;25;100mL容量瓶;膠頭滴管;將蒸餾水注入容量瓶,液面離容量瓶頸刻度線下1~2cm時,改用膠頭滴管滴加蒸餾水至液面與刻度線相切;小于;①③⑤
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:12引用:2難度:0.6
相似題
-
1.用25mL 18.4mol/L的濃硫酸與銅共熱一段時間后,冷卻,過濾除去多余的銅,將濾液稀釋到100mL,所得溶液中
濃度為3mol/L,則此時溶液中CuSO4的物質的量濃度為( )SO2-4A.0.5mol/L B.1.6 mol/L C.1.8 mol/L D.3mol/L 發布:2024/12/30 4:0:1組卷:138引用:6難度:0.5 -
2.標準狀況下,將一充滿HCl氣體的燒瓶倒扣在盛有水的水槽中,HCl氣體被完全吸收,假設溶液沒有損失,則燒瓶內所得溶液的物質的量濃度為( )
A.0.045 mol/L B.1 mol/L C.0.5 mol/L D.2.24mol/L 發布:2024/12/30 6:0:2組卷:17引用:3難度:0.7 -
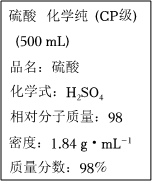 3.如圖是硫酸試劑標簽上的部分內容,據此下列說法正確的是( )
3.如圖是硫酸試劑標簽上的部分內容,據此下列說法正確的是( )A.該硫酸試劑的物質的量濃度為18.4mol?L-1 B.該硫酸可以干燥H2S等酸性氣體,但不可以干燥NH3 C.50mL該H2SO4中加入足量的銅片并加熱,被還原的H2SO4的物質的量為0.46mol D.2.7g Al與足量的該硫酸反應可得到H23.36L 發布:2024/12/30 4:30:1組卷:79引用:3難度:0.8


