84消毒液的有效成分是NaClO,廣泛應用于殺菌、消毒及化工領域。實驗室中利用下圖裝置(部分裝置省略)制備NaClO,并探究氯氣的性質。經查閱到資料可知:“氯氣與水的反應是放熱反應,在加熱條件下氯氣與堿液發生如下反應:3Cl2+6NaOH 70℃ 5NaCl+NaClO3+3H2O。
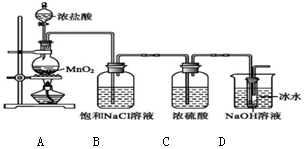
回答下列問題:
(1)裝置A、D中發生反應的離子方程式分別為:
A:MnO2+4H++2Cl- △ Mn2++Cl2↑+2H2OMnO2+4H++2Cl- △ Mn2++Cl2↑+2H2O;D:Cl2+2OH-=Cl-+ClO-+H2OCl2+2OH-=Cl-+ClO-+H2O;
(2)裝置B能否省去的不能不能(填“能”或“不能”),理由是 Cl2中混有的HCl與NaOH反應降低NaClO的產率與純度Cl2中混有的HCl與NaOH反應降低NaClO的產率與純度;
(3)裝置D中采用冰水浴冷卻的目的是 避免生成NaClO3避免生成NaClO3。
(4)理論上制備14.9 g次氯酸鈉,需要Cl2 14.214.2g,消耗MnO2 17.417.4g。
(5)如圖是檢驗Cl2性質的裝置圖示,完成下列問題。
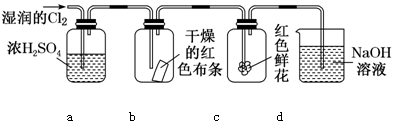
①裝置a中濃H2SO4的作用是 除去Cl2中的H2O除去Cl2中的H2O;該裝置能否省去 不能不能(填“能”或“不能)。
②裝置b、c實驗現象分別為:b 干燥有色布條不褪色干燥有色布條不褪色;c 紅色鮮花褪色紅色鮮花褪色;對比b和c中現象得出的結論是 Cl2本身沒有漂白性Cl2本身沒有漂白性。
70
℃
△
△
【考點】氯及其化合物的綜合應用;氯氣的實驗室制法.
【答案】MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;Cl2+2OH-=Cl-+ClO-+H2O;不能;Cl2中混有的HCl與NaOH反應降低NaClO的產率與純度;避免生成NaClO3;14.2;17.4;除去Cl2中的H2O;不能;干燥有色布條不褪色;紅色鮮花褪色;Cl2本身沒有漂白性
△
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:7引用:2難度:0.5
相似題
-
1.如圖是一些常見含氯產品,根據情況回答下列問題。

(1)下列有關氯單質和氯水的說法正確的是(填序號)。
①液氯是純凈物,氯水是混合物
②氯氣可使濕潤的紅色布條褪色,所以氯氣具有漂白性
③過量的鐵在少量的氯氣中燃燒生成FeCl2
④新制氯水可使藍色石蕊試紙先變紅后褪色
⑤新制氯水放置數天后酸性將減弱
(2)漂白粉常用于對環境和飲用水進行殺菌、消毒,以抑制大規模傳染病爆發。寫出漂白粉在空氣中殺菌消毒的原理。(用化學方程式表示)
(3)據報道,有人在清洗衛生間時,因混合使用“潔廁靈”(主要成分為稀鹽酸)與“84”消毒液(有效成分NaClO),而發生氯氣中毒事件,請從氧化還原的角度分析原因 (用離子方程式表示)。
(4)某“84”消毒液部分標簽如圖所示:
①計算該“84”消毒液的物質的量濃度凈含量:500mL 密度:1.19gcm-3
主要成分:25% NaClO
注意喜項:密封保存,易吸收空氣中的CO2變質mol?L-1。(保留小數點后一位)
②某實驗需用250mL上述消毒液,現用NaClO固體配制。在配制過程中,除需要燒杯、托盤天平處還必需的儀器有(寫三種),下列操作可能使配制溶液濃度偏低的是。
A.移液時,未洗滌燒杯內壁和玻璃棒
B.溶解后未經冷卻就移液
C.移液時,有少量液體濺出
D.定容時,俯視刻度線
E.容量瓶用蒸餾水洗凈后,沒烘干就直接使用
F.定容時,仰視刻度線發布:2025/1/15 8:0:2組卷:35引用:1難度:0.7 -
2.下列有關鹽酸的說法中正確的是( )
A.純凈的鹽酸是純凈物 B.鹽酸就是液態氯化氫 C.鹽酸中所有陽離子所帶的正電荷數與所有陰離子所帶的負電荷數相等 D.濃鹽酸有腐蝕性,稀鹽酸沒有腐蝕性 發布:2025/1/1 8:0:2組卷:4引用:0難度:0.9 -
3.關于鹽酸的敘述正確的是( )
A.鹽酸是純凈物 B.鹽酸是電解質 C.鹽酸是分散系 D.1L 1mol/L 鹽酸中含有HCl分子數為 1NA 發布:2025/1/1 8:0:2組卷:20引用:7難度:0.9


