某研究小組探究AgCl沉淀向Ag2S轉化過程中發生了異常,并進一步探究原因:
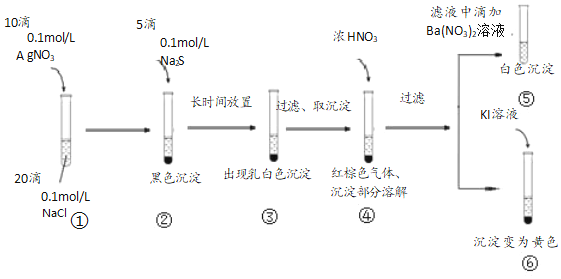
(1)寫出試管①中產生白色沉淀的離子方程式Ag++Cl-═AgCl↓Ag++Cl-═AgCl↓。
(2)用化學方程式表示試管②中產生黑色沉淀的原因2AgCl(s)+S2-(aq)?AgS(s)+2Cl-(aq)2AgCl(s)+S2-(aq)?AgS(s)+2Cl-(aq)。
(3)試管④中加入濃HNO3后的離子反應方程式為S+4H++6NO3-=SO42-+6NO2↑+2H2O或8NO3-+Ag2S+8H+=Ag2SO4+8NO2↑+4H2OS+4H++6NO3-=SO42-+6NO2↑+2H2O或8NO3-+Ag2S+8H+=Ag2SO4+8NO2↑+4H2O。
(4)該小組為探究③中乳白色沉淀的原因可能與空氣中的氧氣有關,設計如圖裝置。
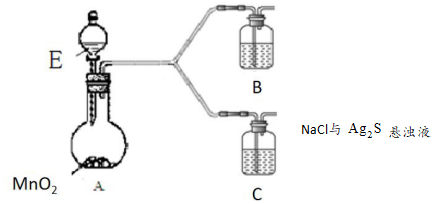
|
現象 |
B:一段時間后,無明顯變化 |
| C:一段時間后,出現乳白色沉淀 |
H2O2
H2O2
溶液。②B中盛放的物質是
Ag2S 的懸濁液
Ag2S 的懸濁液
。③該小組認為C中產生沉淀的反應如下(請補充完整)。
2Ag2S+
1O2
1O2
+4NaCl
4NaCl
+2H2O?2S+4AgCl↓
4AgCl↓
+4NaOH
NaOH
。④請解釋B、C現象不同的原因
C中O2將Ag2S氧化生成S時有Ag+游離出來,NaCl中大量的Cl-與游離的 Ag+結合成AgCl沉淀,由于c(Ag+)減小,有利于③中反應平衡右移,C 中最終出現乳白色沉淀
C中O2將Ag2S氧化生成S時有Ag+游離出來,NaCl中大量的Cl-與游離的 Ag+結合成AgCl沉淀,由于c(Ag+)減小,有利于③中反應平衡右移,C 中最終出現乳白色沉淀
。(5)為了避免在AgCl沉淀向Ag2S轉化過程中出現異常現象,需要控制的反應條件是
NaCl不過量或者隔絕氧氣或者縮短存放時間
NaCl不過量或者隔絕氧氣或者縮短存放時間
。【考點】沉淀溶解平衡.
【答案】Ag++Cl-═AgCl↓;2AgCl(s)+S2-(aq)?AgS(s)+2Cl-(aq);S+4H++6NO3-=SO42-+6NO2↑+2H2O或8NO3-+Ag2S+8H+=Ag2SO4+8NO2↑+4H2O;H2O2;Ag2S 的懸濁液;1O2;4NaCl;4AgCl↓;NaOH;C中O2將Ag2S氧化生成S時有Ag+游離出來,NaCl中大量的Cl-與游離的 Ag+結合成AgCl沉淀,由于c(Ag+)減小,有利于③中反應平衡右移,C 中最終出現乳白色沉淀;NaCl不過量或者隔絕氧氣或者縮短存放時間
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:112引用:1難度:0.4
相似題
-
1.已知常溫下:KsP(AgCl白色)=1.8×10-10,KsP(Ag2S黑色)=2.0×10-48 KsP(Ag2CrO4紅色)=1.9×10-12,下列敘述正確的是( )
A.向AgCl的懸濁液中加入NaBr溶液,白色沉淀轉化為淡黃色,說明KSP(AgCl)<KSP(AgBr) B.將0.001mol?L-1 AgNO3溶液滴入0.001mol?L-1 KCl和0.001mol?L-1 K2CrO4混合溶液中,先產生Ag2CrO4沉淀 C.向AgCl的懸濁液中滴加濃氨水,沉淀溶解,說明AgCl的溶解平衡向右移動 D.測定水體中氯化物的含量,常用標準硝酸銀法進行滴定,滴定時,應加入的指示劑為K2S 發布:2024/12/30 8:0:1組卷:10引用:0難度:0.9 -
2.鐵器表面氧化層的成分有多種:致密的Fe3O4、疏松的FeO(OH)和FeOCl,它們均難溶于水.下列說法錯誤的是( )
A.有氧條件下Fe3O4與Cl-轉化為FeOCl,周圍環境的pH增大 B.FeOCl可自發轉變為FeO(OH),說明FeO(OH)的溶解度小于FeOCl C.檢驗FeO(OH)中是否含有FeOCl,可選用的試劑是稀硫酸和KSCN溶液 D.1molFeOCl完全轉化為Fe3O4時轉移 mol電子13發布:2024/12/19 13:30:1組卷:62引用:3難度:0.5 -
3.高中化學《化學反應原理》模塊從不同的視角對化學反應進行了探究、分析,以下觀點中不正確的是( )
A.難溶電解質在水中達到溶解平衡時,再加入難溶電解質,溶液中各離子濃度不變 B.將TiCl4加入水中并加熱使其轉化為TiO2?xH2O C.乙烯聚合為聚乙烯的反應是熵減的過程,卻能夠自發進行,可知該反應的ΔH<0 D.NaHCO3溶液顯堿性的原因: +H2O?CO 32-+H3O+HCO-3發布:2024/12/30 10:30:1組卷:10引用:4難度:0.7


