某實驗小組制取“84”消毒液(主要成分為NaClO)并探究其性質。
[查閱資料]
①常溫下:16HCl(濃)+2KMnO4=2MnCl2+81H2O+2KCl+5Cl2↑;
②苯為有機物,密度比水小且不溶于水;
③氯、溴、碘的單質均易溶于有機溶劑。
Ⅰ.制取NaClO的裝置如圖1所示(夾持裝置略):
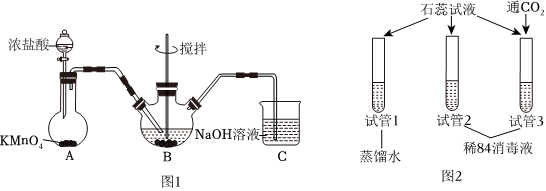
(1)儀器a的名稱為 分液漏斗分液漏斗。
(2)裝置B中發生反應的化學方程式為 Cl2+2NaOH=NaCl+NaClO+H2OCl2+2NaOH=NaCl+NaClO+H2O。
(3)上述裝置存在一個缺陷,會導致“84”消毒液的產率降低,改進的方法是 在A、B之間安裝一個裝有飽和食鹽水的洗氣瓶在A、B之間安裝一個裝有飽和食鹽水的洗氣瓶。
Ⅱ.探究“84”消毒液的性質:
(4)為驗證“84”消毒液的某些性質,實驗小組設計圖2實驗方案。觀察到試管1中溶液不褪色;試管2中溶液變藍,短時間內無明顯現象;試管3中溶液先變藍,通入CO2后,溶液快速褪色。
①試管1的作用是 作對比實驗作對比實驗。
②由試管2、3的現象可得到的結論是 NaClO溶液呈堿性;且能與酸反應,生成的HClO具有漂白性NaClO溶液呈堿性;且能與酸反應,生成的HClO具有漂白性。
③若將試管3中通入的CO2換成鹽酸也可達到相同的效果,且速度更快,但有可能產生Cl2而帶來不良的實驗后果,試用離子方程式解釋產生Cl2的原因 Cl-+ClO-+2H+=Cl2↑+H2OCl-+ClO-+2H+=Cl2↑+H2O。
(5)同學們觀察到“84”消毒液的液體呈淺黃綠色,猜想其中可能溶有氯氣。現設計實驗證明“84”消毒液中溶有氯氣,可供選擇的實驗儀器、藥品:試管、苯、酒精、“84”消毒液。請你簡述實驗操作、現象及結論 取一定量的“84消毒液”置于試管中,向試管中加入苯,充分振蕩,觀察苯層液體顏色未呈現黃綠色取一定量的“84消毒液”置于試管中,向試管中加入苯,充分振蕩,觀察苯層液體顏色未呈現黃綠色。
【考點】氯及其化合物的綜合應用;制備實驗方案的設計.
【答案】分液漏斗;Cl2+2NaOH=NaCl+NaClO+H2O;在A、B之間安裝一個裝有飽和食鹽水的洗氣瓶;作對比實驗;NaClO溶液呈堿性;且能與酸反應,生成的HClO具有漂白性;Cl-+ClO-+2H+=Cl2↑+H2O;取一定量的“84消毒液”置于試管中,向試管中加入苯,充分振蕩,觀察苯層液體顏色未呈現黃綠色
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:11引用:2難度:0.5
相似題
-
1.如圖是一些常見含氯產品,根據情況回答下列問題。

(1)下列有關氯單質和氯水的說法正確的是(填序號)。
①液氯是純凈物,氯水是混合物
②氯氣可使濕潤的紅色布條褪色,所以氯氣具有漂白性
③過量的鐵在少量的氯氣中燃燒生成FeCl2
④新制氯水可使藍色石蕊試紙先變紅后褪色
⑤新制氯水放置數天后酸性將減弱
(2)漂白粉常用于對環境和飲用水進行殺菌、消毒,以抑制大規模傳染病爆發。寫出漂白粉在空氣中殺菌消毒的原理。(用化學方程式表示)
(3)據報道,有人在清洗衛生間時,因混合使用“潔廁靈”(主要成分為稀鹽酸)與“84”消毒液(有效成分NaClO),而發生氯氣中毒事件,請從氧化還原的角度分析原因 (用離子方程式表示)。
(4)某“84”消毒液部分標簽如圖所示:
①計算該“84”消毒液的物質的量濃度凈含量:500mL 密度:1.19gcm-3
主要成分:25% NaClO
注意喜項:密封保存,易吸收空氣中的CO2變質mol?L-1。(保留小數點后一位)
②某實驗需用250mL上述消毒液,現用NaClO固體配制。在配制過程中,除需要燒杯、托盤天平處還必需的儀器有(寫三種),下列操作可能使配制溶液濃度偏低的是。
A.移液時,未洗滌燒杯內壁和玻璃棒
B.溶解后未經冷卻就移液
C.移液時,有少量液體濺出
D.定容時,俯視刻度線
E.容量瓶用蒸餾水洗凈后,沒烘干就直接使用
F.定容時,仰視刻度線發布:2025/1/15 8:0:2組卷:35引用:1難度:0.7 -
2.下列有關鹽酸的說法中正確的是( )
A.純凈的鹽酸是純凈物 B.鹽酸就是液態氯化氫 C.鹽酸中所有陽離子所帶的正電荷數與所有陰離子所帶的負電荷數相等 D.濃鹽酸有腐蝕性,稀鹽酸沒有腐蝕性 發布:2025/1/1 8:0:2組卷:4引用:0難度:0.9 -
3.關于鹽酸的敘述正確的是( )
A.鹽酸是純凈物 B.鹽酸是電解質 C.鹽酸是分散系 D.1L 1mol/L 鹽酸中含有HCl分子數為 1NA 發布:2025/1/1 8:0:2組卷:20引用:7難度:0.9


