如圖是實驗室常用的裝置,請回答問題。

(1)寫出標有序號的儀器名稱:①分液漏斗分液漏斗。
(2)實驗室用石灰石和稀鹽酸制取二氧化碳,應選用的發生裝置是 BB(選填裝置字母序號),反應原理為 CaCO3+2HCl=CaCl2+H2O+CO2↑CaCO3+2HCl=CaCl2+H2O+CO2↑(用化學方程式表示)。若用D裝置收集二氧化碳,氣體應從導管口 aa進(選填a或b)。
(3)E裝置所示的實驗觀察到的現象是 蠟燭從下往上依次熄滅蠟燭從下往上依次熄滅,證明二氧化碳具有 不支持燃燒、也不能燃燒不支持燃燒、也不能燃燒和 密度比空氣大密度比空氣大性質。
(4)向裝置F中通入二氧化碳,觀察到的現象是 由紫色變成紅色由紫色變成紅色,產生此現象的原因是 CO2+H2O=H2CO3CO2+H2O=H2CO3(用化學方程式表示)。
(5)實驗室用H2O2溶液制取氧氣,常用MnO2作催化劑。FeCl3對H2O2分解也有催化作用。為比較MnO2和FeCl3對H2O2分解快慢的不同影響,用下圖左裝置進行實驗:啟動傳感器,注入H2O2溶液。氧氣體積分數隨時間變化情況如下:

a.初始時氧氣的體積分數不為0,原因是 裝置中含有空氣,空氣中約含21%氧氣裝置中含有空氣,空氣中約含21%氧氣。
b.寫出使H2O2分解較快的催化劑及判斷依據:MnO2,因為MnO2作催化劑時,產生等量氧氣所需的時間比FeCl3更短MnO2,因為MnO2作催化劑時,產生等量氧氣所需的時間比FeCl3更短。
(6)實驗室制取氣體選擇收集方法時,下列性質:①顏色②密度③溶解性④可燃⑤能否與水反應,必須考慮的是 ②③⑤②③⑤。
【答案】分液漏斗;B;CaCO3+2HCl=CaCl2+H2O+CO2↑;a;蠟燭從下往上依次熄滅;不支持燃燒、也不能燃燒;密度比空氣大;由紫色變成紅色;CO2+H2O=H2CO3;裝置中含有空氣,空氣中約含21%氧氣;MnO2,因為MnO2作催化劑時,產生等量氧氣所需的時間比FeCl3更短;②③⑤
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/7/1 8:0:9組卷:12引用:2難度:0.5
相似題
-
1.學習化學離不開化學實驗,請結合下圖回答問題。
資料:碳酸鈉與二氧化碳、水反應生成可溶于水的碳酸氫鈉。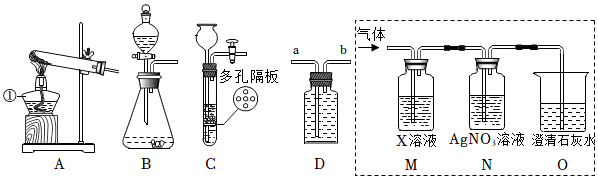
(1)寫出圖中標號①儀器的名稱。
(2)利用裝置B制取氧氣,反應的化學方程式為。若用D裝置收集氧氣,則氣體應該從(填“a”或“b”)進入。
(3)實驗室用鋅粒與稀硫酸制取H2,其反應的化學方程式為。裝置C與B相比較,其優點是。
(4)實驗室用石灰石與鹽酸制取的CO2通入到澄清石灰水,石灰水并未變渾濁。將氣體依次通過裝置M、N、O后,發現N中溶液不變渾濁,O中溶液變渾濁。則裝置M中X溶液為(填字母)。
A.飽和Na2CO3溶液
B.飽和NaHCO3溶液
C.飽和NaOH溶液
(5)若集氣瓶中充滿CO2氣體,將分液漏斗①中的NaOH溶液滴入瓶中,稍作振蕩,發現氣球(填“膨脹”或“縮小”),其原因用化學方程式表示:若要氣球恢復原狀,應關閉分液漏斗①,打開分液漏斗②,滴入溶液(填化學式,忽略滴入液體的體積)。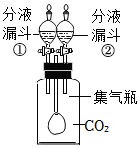 發布:2024/12/25 14:0:2組卷:85引用:3難度:0.3
發布:2024/12/25 14:0:2組卷:85引用:3難度:0.3 -
2.如圖中的A-E是化學實驗中常用的幾種裝置,請按要求回答有關問題.

(1)利用圖中A、C裝置的組合可以制取的一種氣體是;寫出實驗室制取該氣體的化學方程式.
(2)若實驗室制取二氧化碳氣體,應選用圖中裝置的組合是;寫出實驗室制取二氧化碳氣體的化學方程式;證明集氣瓶中充滿二氧化碳的方法是.
(3)寫出實驗室用鋅與稀硫酸制取氫氣的化學方程式.發布:2024/12/25 14:30:2組卷:36引用:2難度:0.5 -
3.認識氧氣和二氧化碳。
(1)唐代化學家馬和最先發現氧氣,他認為空氣中存在“陰陽二氣”,陽氣比陰氣多得多。則氧氣屬于馬和認為的(填“陽氣”或“陰氣”)。
(2)現用下列裝置制取氣體。
①甲儀器的名稱是。
②實驗室用高錳酸鉀制取氧氣應選用的發生裝置為(填標號),該反應的化學方程式為。若選用裝置C制取氧氣,則反應的化學方程式為,能用E收集氧氣的原因有。
③實驗室欲隨開隨停制備二氧化碳,選擇的發生裝置為(填標號)。
④選用制取氣體的發生裝置需考慮反應物的狀態和。發布:2024/12/25 13:0:1組卷:4引用:2難度:0.5


