 氮的固定是指將氮元素由游離態轉化為化合態的過程.據報道,常溫、常壓、光照條件下,N2在摻有少量氧化鐵的二氧化鈦催化劑表面能與水發生反應,生成的主要產物為NH3,相應的熱化學方程式為:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)ΔH=+1530.0kJ/mol.目前工業合成氨的原理是:N2(g)+3H2(g)?2NH3(g)ΔH=-93.0kJ/mol.
氮的固定是指將氮元素由游離態轉化為化合態的過程.據報道,常溫、常壓、光照條件下,N2在摻有少量氧化鐵的二氧化鈦催化劑表面能與水發生反應,生成的主要產物為NH3,相應的熱化學方程式為:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)ΔH=+1530.0kJ/mol.目前工業合成氨的原理是:N2(g)+3H2(g)?2NH3(g)ΔH=-93.0kJ/mol.
回答下列問題:
(1)寫出表示氫氣燃燒熱的熱化學方程式 H2(g)+12O2(g)=H2O(l)ΔH=-286.0kJ/molH2(g)+12O2(g)=H2O(l)ΔH=-286.0kJ/mol.
(2)在恒溫恒容密閉容器中進行的工業合成氨反應,下列能表示達到平衡狀態的是 ABEABE(填序號).
A.混合氣體的壓強不再發生變化
B.混合氣體的平均相對分子質量不再發生變化
C.三種物質的濃度比恰好等于化學方程式中各物質的化學計量數之比
D.單位時間內斷開3a個H-H鍵的同時形成6a個N-H鍵
E.反應容器中N2、NH3的物質的量的比值不再發生變化
(3)在一定溫度下,向容積不變(始終為10L)的密閉容器中加入2mol N2、8mol H2及固體催化劑.10分鐘后反應達到平衡狀態,容器內氣體壓強變為起始的80%,10分鐘內用氮氣的濃度表示的化學反應速率為 0.01mol?L-1?min-10.01mol?L-1?min-1,平衡時氮氣的轉化率為 50%50%.則該溫度下反應的平衡常數K=3.2L2/mol23.2L2/mol2(計算結果可用分數表示).
(4)原料氣H2可通過反應 CH4(g)+H2O(g)═CO(g)+3H2(g)獲取,已知該反應中,當初始混合氣中的n(H2O)n(CH4) 恒定時,溫度、壓強對平衡混合氣CH4含量的影響如圖所示:
①圖中,兩條曲線表示壓強的關系是:P1<<P2(填“>”、“=”或“<”).
②該反應為 吸熱吸熱反應(填“吸熱”或“放熱”).
1
2
1
2
n
(
H
2
O
)
n
(
C
H
4
)
【考點】產物的百分含量隨濃度、時間的變化曲線;熱化學方程式.
【答案】H2(g)+O2(g)=H2O(l)ΔH=-286.0kJ/mol;ABE;0.01mol?L-1?min-1;50%;3.2L2/mol2;<;吸熱
1
2
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/27 10:35:59組卷:26引用:6難度:0.5
相似題
-
1.Ⅰ.已知某可逆反應:aA(g)+bB(g)?cC(g)+dD(g).請回答下列問題:
(1)根據實驗測定結果,描繪出了該反應達到平衡狀態時及改變外界條件后,反應速率與時間的關系圖象(如圖1所示):有利于提高D產量的變化過程是圖象中的段;引起該變化過程的外界條件是.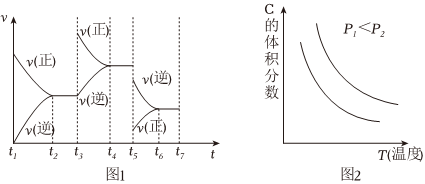 (2)根據實驗測定結果描繪出了圖2.由此圖象可以得出,升高溫度,上述平衡將向 (填“正反應“或“逆反應”)方向移動;反應計量數之間的關系:a+bc+d(填“大于”、“小于”、“等于”
(2)根據實驗測定結果描繪出了圖2.由此圖象可以得出,升高溫度,上述平衡將向 (填“正反應“或“逆反應”)方向移動;反應計量數之間的關系:a+bc+d(填“大于”、“小于”、“等于”
或“不確定”).
Ⅱ.工業合成氨反應如下:N2+3H22NH3.請回答下列問題:高溫、高壓催化劑
(1)在一定條件下2L的密閉容器中進行實驗,并測得下列數據:
則10s內,用氫氣表示的化學反應速率是物質 N2 H2 NH3 起始(mol) 2 7 0 10s(mol) 1.6 平衡時(mol) 2 ,該反應的化學平衡常數是.
(2)根據混合氣體各成分的物質性質,你認為工業上將氨氣從混合氣體中分離出來的措施是,從而達到反應氣體循環利用的目的.實驗室檢驗氨氣的方法是.發布:2024/11/11 8:0:1組卷:32引用:1難度:0.5 -
2.煤是重要的化石燃料和化工原料,有關煤的綜合利用得到廣泛深入的研究。其中煤的氣化是煤的綜合利用的重要途徑。
I.煤的催化氣化生成CO,主要反應為:①C(s)+CO2(g)?2CO(g)△H
堿金屬催化劑顯示出了優越的催化性能。Mckee和Chatterji在1975年提出了由堿金屬的氧化還原循環的氧傳遞機理:
②K2CO3(s)+2C(s)?2K(g)+3CO(g)△H1=+899.4kJ?mol-1
③2K(g)+CO2(g)?K2O(s)+CO(g)△H2=-98.4kJ?mol-1
④K2O(s)+CO2(g)?K2CO3(s)△H3=-456.0kJ?mol-1
(1)由此計算△H=
(2)在2L的密閉容器中進行投入1molC和3molCO2催化劑作用下發生反應①,CO的物質的量分數φ(CO)/%隨溫度和壓強的變化曲線如圖,根據圖象回答下列問題: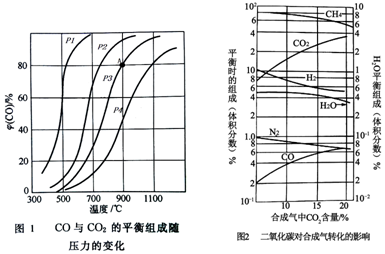
①若在900℃,壓力為P3條件下反應經過10min達到平衡,則0~10min內的反應速率v(CO)為。
②該可逆反應達到平衡的標志是。
A.v(CO2)正=2v(CO)逆
B.CO2和CO的濃度之比為1:2
C.容器內的總壓強不再隨時間而變化
D.混合氣體的密度不再隨時間變化
③圖中壓強(P1、P2、P3、P4)的大小順序為:。其判斷的理由是。
④可逆反應的平衡常數可以用平衡濃度計算,也可以用平衡分壓代替平衡濃度計算(分壓=總壓×物質的量分數)。反應①在圖中A點的總壓強為1MPa,列式計算A點的平衡常數Kp=。
II.煤氣的甲烷化是煤綜合利用的重要方法。其基本反應為:
反應①:CO(g)+3H2(g)?CH4(g)+H2O(g)△H=-219.3kJ?mol-1
反應生成的水與CO發生反應:
反應②:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-38.4kJ?mol-1
離開反應器的混合氣體的組成取決于原料氣的組成、壓強和溫度,圖2表示比為3.8時二氧化碳含量對合成氣轉化達到平衡的影響。φ(H2)φ(CO)
由圖象可知,隨離開反應器的混合氣體中二氧化碳的含量增加,達到平衡時甲烷的量(填“增大”、“減小”或“不變”,下同),其原因為。發布:2024/6/27 10:35:59組卷:38引用:2難度:0.5 -
3.可逆反應:aA(g)+bB(g)?cC(g)+dD(g)△H,試根據圖回答:
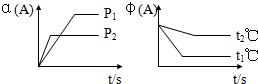
[A的轉化率(%)表示為α(A)、A的含量(%)表示為φ(A)]
(1)壓強P1P2(填<或>)
(2)體積(a+b)(c+d)(填<或>)
(3)溫度t1℃t2℃(填<或>)
(4)△H值是(填正、負)發布:2024/6/27 10:35:59組卷:44引用:6難度:0.3


