科學(xué)家們致力于消除氮氧化物對大氣的污染。回答下列問題:
(1)NO在空氣中存在如下反應(yīng):2NO(g)+O2(g)?2NO2(g)△H,該反應(yīng)共有兩步
第一步反應(yīng)為2NO(g)?N2O2(g)△H1<0;請寫出第二步反應(yīng)的熱化學(xué)方程式
(△H2用含△H、△H1的式子來表示):N2O2(g)+O2(g) 2NO2(g)△H2=△H-△H1N2O2(g)+O2(g)
2NO2(g)△H2=△H-△H1N2O2(g)+O2(g) 2NO2(g)△H2=△H-△H1。
2NO2(g)△H2=△H-△H1。
(2)溫度為T1時,在兩個容積均為1 L的恒容密閉容器中僅發(fā)生反應(yīng):2NO2(g)?2NO(g)+O2 (g),容器I中5min達(dá)到平衡。相關(guān)數(shù)據(jù)如表所示:
 2NO2(g)△H2=△H-△H1
2NO2(g)△H2=△H-△H1 2NO2(g)△H2=△H-△H1
2NO2(g)△H2=△H-△H1| 容器編號 | 物質(zhì)的起始濃度(mol/L) | 物質(zhì)的平衡濃度(mol/L) | ||
| c(NO2) | c(NO) | c(O2) | c(O2) | |
| Ⅰ | 0.6 | 0 | 0 | 0.2 |
| Ⅱ | 0.3 | 0.5 | 0.2 | |
正反應(yīng)
正反應(yīng)
(“正反應(yīng)”、“逆反應(yīng)”、“達(dá)平衡”)方向進(jìn)行。②達(dá)到平衡時,容器I與容器II中的總壓強之比為
c
c
。a.>1 b.=1 c.<1
(3)NO2存在如下平衡:2NO2(g)?N2O4(g)△H<0,在一定條件下NO2與N2O4的消耗速率與各自的分壓
(分壓=總壓×物質(zhì)的量分?jǐn)?shù))有如下關(guān)系:υ(NO2)=k1?P2(NO2),υ(N2O4)=k2?P(N2O4),相應(yīng)的速率與其分壓關(guān)系如圖所示。一定溫度下,k1、k2與平衡常數(shù)kp(壓力平衡常數(shù),用平衡分壓代替平衡濃度計算)間的關(guān)系是k1=
2k2?Kp
2k2?Kp
;在如圖1.標(biāo)出點中,指出能表示反應(yīng)達(dá)到平衡狀態(tài)的點是B、D
B、D
,理由是達(dá)到平衡時,N2O4與NO2的消耗速率滿足條件υ(NO2)=2υ(N2O4)
達(dá)到平衡時,N2O4與NO2的消耗速率滿足條件υ(NO2)=2υ(N2O4)
。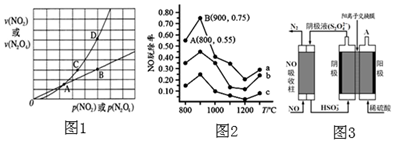
(4)可用NH3去除 NO,其反應(yīng)原理4NH3+6NO=5N2+6H2O.不同溫度條件下,n(NH3):n(NO)的物質(zhì)的量之比分別為 4:1、3:1、1:3 時,得到NO 脫除率曲線如圖2所示:
①曲線 a 中,NO 的起始濃度為6×10-4mg?m-3,從A點到 B 點經(jīng)過0.8s,該時間段內(nèi) NO 的脫除速率為
1.5×10-4
1.5×10-4
mg?m-3?s-1。②曲線b對應(yīng)NH3與NO的物質(zhì)的量之比是
3:1
3:1
。(5)還可用間接電解法除 NO.其原理如圖3所示:
①從A口中出來的物質(zhì)的是
O2和較濃的硫酸
O2和較濃的硫酸
。②寫出電解池陰極的電極反應(yīng)式
2HSO3-+2H++2e-=S2O42-+2H2O
2HSO3-+2H++2e-=S2O42-+2H2O
。③用離子方程式表示吸收池中除去 NO 的原理
2NO+2S2O42-+2H2O=N2+4HSO3-
2NO+2S2O42-+2H2O=N2+4HSO3-
【考點】化學(xué)平衡的計算.
【答案】N2O2(g)+O2(g) 2NO2(g)△H2=△H-△H1;正反應(yīng);c;2k2?Kp;B、D;達(dá)到平衡時,N2O4與NO2的消耗速率滿足條件υ(NO2)=2υ(N2O4);1.5×10-4;3:1;O2和較濃的硫酸;2HSO3-+2H++2e-=S2O42-+2H2O;2NO+2S2O42-+2H2O=N2+4HSO3-
2NO2(g)△H2=△H-△H1;正反應(yīng);c;2k2?Kp;B、D;達(dá)到平衡時,N2O4與NO2的消耗速率滿足條件υ(NO2)=2υ(N2O4);1.5×10-4;3:1;O2和較濃的硫酸;2HSO3-+2H++2e-=S2O42-+2H2O;2NO+2S2O42-+2H2O=N2+4HSO3-
 2NO2(g)△H2=△H-△H1;正反應(yīng);c;2k2?Kp;B、D;達(dá)到平衡時,N2O4與NO2的消耗速率滿足條件υ(NO2)=2υ(N2O4);1.5×10-4;3:1;O2和較濃的硫酸;2HSO3-+2H++2e-=S2O42-+2H2O;2NO+2S2O42-+2H2O=N2+4HSO3-
2NO2(g)△H2=△H-△H1;正反應(yīng);c;2k2?Kp;B、D;達(dá)到平衡時,N2O4與NO2的消耗速率滿足條件υ(NO2)=2υ(N2O4);1.5×10-4;3:1;O2和較濃的硫酸;2HSO3-+2H++2e-=S2O42-+2H2O;2NO+2S2O42-+2H2O=N2+4HSO3-【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復(fù)制發(fā)布。
發(fā)布:2024/6/27 10:35:59組卷:51引用:4難度:0.5
相似題
-
1.氫氣最早于16世紀(jì)被人工制取出來,氫氣是一種清潔能源。
(1)利用光伏電池電解水制H2是氫能的重要來源。已知:H-H鍵、O=O鍵、H-O鍵的鍵能依次為436kJ?mol-1、495kJ?mol-1、463kJ?mol-1。則2H2O(g)═2H2(g)+O2(g)△H=kJ?mol-1。
(2)T1℃時,向5L恒容密閉容器中充入0.5molCH4,只發(fā)生反應(yīng)2CH4(g)?C2H4(g)+2H2(g),達(dá)到平衡時,測得c(C2H4)=2c(CH4),CH4的轉(zhuǎn)化率為;保持其他條件不變,溫度改為T2℃,經(jīng)25s后達(dá)到平衡,測得c(CH4)=2c(C2H4),則0~25s內(nèi)v(C2H4)=mol?L-1?s-1。
(3)CH4分解時幾種氣體的平衡分壓(pPa)的對數(shù)值lgp與溫度的關(guān)系如圖所示。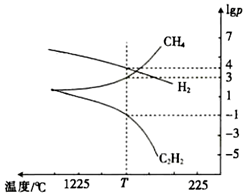
①T℃時,向一恒容密閉容器中通入一定量的CH4(g)、C2H4(g)和H2(g),只發(fā)生反應(yīng)2CH4(g)?C2H2(g)+3H2(g)ΔH,ΔH(填“>”或“<”)0,此時的平衡常數(shù)Kp=(用平衡分壓代替濃度進(jìn)行計算)Pa2。
②若只改變一個反應(yīng)條件使Kp變大,則該條件是(填標(biāo)號)。
A.減小C2H2的濃度
B.升高溫度
C.增大壓強
D.加入合適的催化劑
(4)工業(yè)上,以KNH2和液氨為電解質(zhì),以石墨為電極,電解液氨制備H2。陽極的電極反應(yīng)式為,一段時間后陰、陽兩極收集到的氣體質(zhì)量之比為。發(fā)布:2025/1/4 8:0:1組卷:9引用:3難度:0.5 -
2.反應(yīng) 4A(g)+5B(g)?4C(g)+6D(g)在 5L 的密閉容器中進(jìn)行,半分鐘后,C 的物質(zhì)的量增 加了 0.30mol。下列敘述正確的是( )
A.容器中 D 的物質(zhì)的量至少為 0.45 mol B.A 的平均反應(yīng)速率是 0.010 mol?L-1?s-1 C.容器中 A、B、C、D 的物質(zhì)的量之比一定是 4:5:4:6 D.容器中 A 的物質(zhì)的量一定增加了 0.30 mol 發(fā)布:2024/12/30 19:30:2組卷:67引用:6難度:0.6 -
3.將等物質(zhì)的量的A、B混合于2L的密閉容器中,發(fā)生如下反應(yīng):3A(g)+B(g)?xC(g)+2D(g),經(jīng)5min后,測得D的濃度為0.5mol/L,c(A):c(B)=3:5,C的平均反應(yīng)速率為0.1mol/(L?min).求:
(1)此時A的濃度c(A)=mol/L,反應(yīng)開始前容器中的A、B的物質(zhì)的量:n(A)=n(B)=mol;
(2)B的平均反應(yīng)速率v(B)=mol/(L?min);
(3)x的值為.發(fā)布:2024/12/30 19:0:1組卷:163引用:26難度:0.3
相關(guān)試卷


