海水是巨大的資源寶庫,在海水淡化及綜合利用方面,天津市位居全國前列。回答下列問題:
(1)請寫出海水淡化的一種方法:蒸餾法、電滲析法或離子交換法蒸餾法、電滲析法或離子交換法。
(2)從海水中提取的粗鹽中含有Ca2+、Mg2+、SO2-4等雜質(zhì)離子,精制時常用的試劑有:
a稀鹽酸;
b氯化鋇溶液;
c氫氧化鈉溶液;
d碳酸鈉溶液。
加入試劑的正確順序是 bcda或bdcabcda或bdca(填字母)。
利用海水可以提取溴和鎂,提取過程如圖,
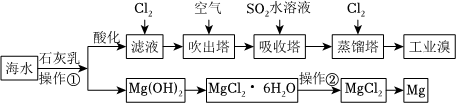
(3)在實驗室中進行操作①時,必需的玻璃儀器除燒杯外還有 玻璃棒、漏斗玻璃棒、漏斗。
(4)操作②為 在氯化氫氣流中加熱在氯化氫氣流中加熱。
(5)提取溴的過程中,經(jīng)過2次Br-→Br2轉(zhuǎn)化的目的是 富集溴元素富集溴元素。
(6)吸收塔中發(fā)生反應的離子方程式為 Br2+SO2+2H2O=4H++2Br-+SO2-4Br2+SO2+2H2O=4H++2Br-+SO2-4,由此反應可知,除環(huán)境保護外,在工業(yè)生產(chǎn)中應解決的主要問題是 強酸對設備的嚴重腐蝕強酸對設備的嚴重腐蝕。
(7)工業(yè)上常用上述流程“空氣吹出法”實現(xiàn)海水提溴,將1m3海水濃縮至1L,使用該法最終得到36gBr2,若提取率為60%,則原海水中溴的濃度為 6060mg/L。
SO
2
-
4
SO
2
-
4
SO
2
-
4
【考點】海水資源及其綜合利用;海水淡化.
【答案】蒸餾法、電滲析法或離子交換法;bcda或bdca;玻璃棒、漏斗;在氯化氫氣流中加熱;富集溴元素;Br2+SO2+2H2O=4H++2Br-+;強酸對設備的嚴重腐蝕;60
SO
2
-
4
【解答】
【點評】
聲明:本試題解析著作權(quán)屬菁優(yōu)網(wǎng)所有,未經(jīng)書面同意,不得復制發(fā)布。
發(fā)布:2024/9/16 1:0:9組卷:140引用:3難度:0.6
相似題
-
1.一位海上遇難的水手,隨著木排在海上漂流.他用完了淡水,感到異常口渴,但他不喝海水,因為他知道海水會致命,主要原因是( )
A.海水有苦澀味,根本喝不下去 B.海水中含有多種鹽,能使腸胃腐爛致人死亡 C.海水中有許多微生物,有些微生物能致人死亡 D.海水會造成人體水分從血液和組織內(nèi)脫離出來,進入腸胃中,使人脫水死亡 發(fā)布:2024/12/27 8:0:2組卷:15引用:2難度:0.9 -
2.海水是一個巨大的資源寶庫,如圖是從海水中提取鎂的流程圖。以下說法錯誤的是( )

A.反應①~⑤中,氧化還原反應有1個 B.電解槽中的反應在常溫下即可發(fā)生,節(jié)約能源 C.使用貝殼為原料制備Ca(OH)2,可降低生產(chǎn)成本 D.實驗室模擬濃縮池中的過程,需要在HCl氣氛中蒸發(fā)濃縮 發(fā)布:2024/11/24 20:30:1組卷:69引用:2難度:0.7 -
3.鎂及其合金是用途很廣的金屬材料。大量的鎂是從海水中提取的,其中的主要步驟如圖:
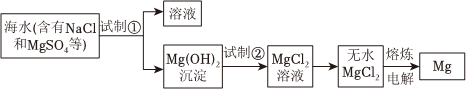
下列說法不正確的是( )A.為了節(jié)省原料,海水可選用提取粗食鹽后的母液 B.為了使MgSO4轉(zhuǎn)化為Mg(OH)2,工業(yè)上試劑①主要選用NaOH C.加入試劑①后,可用過濾得到Mg(OH)2沉淀 D.鎂與鋁等金屬按一定比例制成的合金,由于其密度小、強度大,可用于制造飛機 發(fā)布:2024/10/27 1:30:1組卷:111引用:2難度:0.8


