(1)下表是第三周期部分元素氧化物和氟化物的熔點和摩氏硬度:
| 化合物 | NaF | MgF2 | MgO | SiF4 | SiO2 |
| 熔點/K | 1266 | 1534 | 3125 | 183 | 1983 |
| 摩氏硬度 | 3.2 | 6.0 | 6.5 | 7 |
①基態硅原子的價電子排布式是
3s23p2
3s23p2
,SiO2中硅原子的雜化軌道類型是sp3
sp3
.②請解釋幾種氟化物熔點差異的主要原因
NaF與MgF2為離子晶體,SiF4為分子晶體,故SiF4的熔點低;Mg2+的半徑比Na+的半徑小,Mg2+帶2個單位正電荷數比Na+多,故MgF2的熔點比NaF高;
NaF與MgF2為離子晶體,SiF4為分子晶體,故SiF4的熔點低;Mg2+的半徑比Na+的半徑小,Mg2+帶2個單位正電荷數比Na+多,故MgF2的熔點比NaF高;
.③請解釋MgF2和MgO摩氏硬度差異的主要原因
因為O2-所帶電荷多于F-,所以MgO晶體中離子的晶格能大于MgF2,故摩式硬度較大
因為O2-所帶電荷多于F-,所以MgO晶體中離子的晶格能大于MgF2,故摩式硬度較大
.(2)等電子體CO與N2分子的結構式可分別表示為C≡O和N≡N.兩者分子中有配位鍵的是
CO
CO
;結合事實判斷CO和N2相對更活潑的是CO,斷裂CO分子的第一個π鍵所需的能量(1071.9kJ/mol-798.9kJ/mol=273kJ/mol),比斷開N2的第一個化學鍵所需能量(941.7kJ/mol-418.4kJ/mol=523.3kJ/mol)小
CO,斷裂CO分子的第一個π鍵所需的能量(1071.9kJ/mol-798.9kJ/mol=273kJ/mol),比斷開N2的第一個化學鍵所需能量(941.7kJ/mol-418.4kJ/mol=523.3kJ/mol)小
(填化學式),試用下表中的鍵能數據解釋相對活潑的原因| CO | C-O | C=O | C≡O |
| 鍵能(kJ?mol - 1 | 357.7 | 798.9 | 1071.9 |
| N2 | N-N | N=N | N≡N |
| 鍵能(kJ?mol - 1 | 154.8 | 418.4 | 941.7 |
6NO+P4=3N2+P4O6
6NO+P4=3N2+P4O6
.(4)氫鍵的形成對物質的性質具有一定的影響.
 比
比  的沸點
的沸點高
高
.(填高或低)【答案】3s23p2;sp3;NaF與MgF2為離子晶體,SiF4為分子晶體,故SiF4的熔點低;Mg2+的半徑比Na+的半徑小,Mg2+帶2個單位正電荷數比Na+多,故MgF2的熔點比NaF高;;因為O2-所帶電荷多于F-,所以MgO晶體中離子的晶格能大于MgF2,故摩式硬度較大;CO;CO,斷裂CO分子的第一個π鍵所需的能量(1071.9kJ/mol-798.9kJ/mol=273kJ/mol),比斷開N2的第一個化學鍵所需能量(941.7kJ/mol-418.4kJ/mol=523.3kJ/mol)小;6NO+P4=3N2+P4O6;高
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:24引用:1難度:0.1
相似題
-
 1.著名化學家徐光憲在稀土化學等領域取得了卓越成就,被譽為“稀土界的袁隆平”。稀土元素包括鈧、釔和鑭系元素。
1.著名化學家徐光憲在稀土化學等領域取得了卓越成就,被譽為“稀土界的袁隆平”。稀土元素包括鈧、釔和鑭系元素。
請回答下列問題:
(1)寫出基態二價鈧離子(Sc2+)的核外電子排布式,其中
電子占據的軌道數為。
(2)在用重量法測定鑭系元素和使鑭系元素分離時,總是使之先轉換成草酸鹽,然后
經過灼燒而得其氧化物,如2LnCl3+3H2C2O4+nH2O=Ln2(C2O4)3?nH2O+6HCl。
①H2C2O4中碳原子的雜化軌道類型為;1 mol H2C2O4分子中含σ鍵和π鍵的數目之比為。
②H2O的VSEPR模型為;寫出與H2O互為等電子體的一種陰離子的化學式。
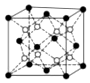
③HCl和H2O可以形成相對穩定的水合氫離子鹽晶體,如HCl?2H2O,HCl?2H2O中含有H5O2+,結構為 ,在該離子中,存在的作用力有
,在該離子中,存在的作用力有
a.配位鍵b。極性鍵c。非極性鍵d。離子鍵e。金屬鍵f。氫鍵g。范德華力 h.π鍵i。σ鍵
(3)表列出了核電荷數為21~25的元素的最高正化合價:
對比上述五種元素原子的核外電子排布與元素的最高正化合價,你發現的規律是元素名稱 鈧 鈦 釩 鉻 錳 元素符號 Sc Ti V Cr Mn 核電荷數 21 22 23 24 25 最高正價 +3 +4 +5 +6 +7
(4)PrO2(二氧化鐠)的晶胞結構與CaF2相似,晶胞中Pr(鐠)原子位于面心和頂點。假設相距最近的Pr原子與O原子之間的距離為a pm,則該晶體的密度為g?cm-3(用NA表示阿伏加德羅常數的值,不必計算出結果)。發布:2025/1/5 8:0:1組卷:29引用:1難度:0.6 -
2.新型鈣鈦礦太陽能電池具備更加清潔、便于應用、制造成本低和效率高等顯著優點。 一種鈣鈦礦太陽能電池材料的晶胞如圖1所示。請按要求回答下列有關問題
(1)構成CH3NH3+的三種元素中電負性最小的是; 寫出碳原子的電子排布式為。
(2)Pb與C同主族,比C的周期序數大4,寫出Pb原子最外層電子的軌道表示式(即電子排布圖)。
(3)有關NH3的結構與性質探究
①NH3分子中所含化學鍵是(從“極性鍵”、“非極性鍵”、“配位鍵”、“離子鍵”、“σ鍵”或“π鍵”中選填符合的名稱);N原子的雜化形式為。
②NH3分子的VSEPR模型名稱為,分子的空間結構(即立體構型) 為。
③如圖2所示,探究NH3的性質時,打開止水夾,擠壓膠頭滴管,可以觀察到燒瓶中迅速產生紅色噴泉。請用必要的分子結構與性質的知識和化學用語解釋產生該現象的原因:、。
(4)該鈣鈦礦太陽能電池材料的化學式為;該晶胞中,與I-緊鄰的I-個數為; 測定其晶體結構特征最可靠的方法是實驗。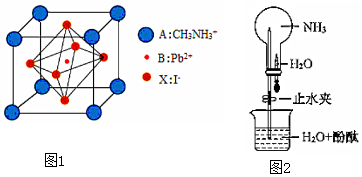 發布:2025/1/5 8:0:1組卷:85引用:1難度:0.5
發布:2025/1/5 8:0:1組卷:85引用:1難度:0.5 -
3.下列各組表述中,正確的是( )
A.基態核外電子的排布為1s22s22p63s23p4的原子3p能級有一個空軌道 B.第四周期中,未成對電子數最多的原子為Mn C.Fe2+的基態核外電子排布為1s22s22p63s23p63d6 D.2P能級有2個未成對電子的基態原子的價電子排布一定為2s22p2 發布:2025/1/6 6:0:5組卷:50引用:3難度:0.7


