鈦被譽為“21世紀的金屬”,可呈現多種化合價。其中以+4價的Ti最為穩定。
回答下列問題:
(1)基態Ti原子的價電子軌道表示式為 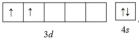
 。
。
(2)已知電離能:I2(Ti)=1310kJ/mol,I2(K)=3051kJ/mol。I2(Ti)<I2(K),其原因為 軌道中電子處于全滿、全空或半滿時較穩定,K+失去的是全充滿的3p6電子,Ti+失去的是4s1電子,失電子前者較后者難軌道中電子處于全滿、全空或半滿時較穩定,K+失去的是全充滿的3p6電子,Ti+失去的是4s1電子,失電子前者較后者難。
(3)鈦某配合物可用于催化環烯烴聚合,其結構如圖1所示:
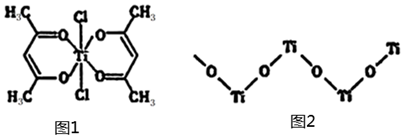
①鈦的配位數為 66_,碳原子的雜化類型 sp3、sp2sp3、sp2。
②該配合物中存在的化學鍵有 bdbd(填字母標號)。
a離子鍵
b.配位鍵
c金屬鍵
d.共價鍵
e.氫鍵
(4)已知TiO2與濃硫酸反應生成硫酸氧鈦,硫酸氧鈦晶體中陽離子為鏈狀聚合形式的離子,結構如圖2所示,該陽離子化學式為 TiO2+或(TiO)2n+nTiO2+或(TiO)2n+n。


(
T
i
O
)
2
n
+
n
(
T
i
O
)
2
n
+
n
【答案】 ;軌道中電子處于全滿、全空或半滿時較穩定,K+失去的是全充滿的3p6電子,Ti+失去的是4s1電子,失電子前者較后者難;6;sp3、sp2;bd;TiO2+或
;軌道中電子處于全滿、全空或半滿時較穩定,K+失去的是全充滿的3p6電子,Ti+失去的是4s1電子,失電子前者較后者難;6;sp3、sp2;bd;TiO2+或
 ;軌道中電子處于全滿、全空或半滿時較穩定,K+失去的是全充滿的3p6電子,Ti+失去的是4s1電子,失電子前者較后者難;6;sp3、sp2;bd;TiO2+或
;軌道中電子處于全滿、全空或半滿時較穩定,K+失去的是全充滿的3p6電子,Ti+失去的是4s1電子,失電子前者較后者難;6;sp3、sp2;bd;TiO2+或(
T
i
O
)
2
n
+
n
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/4/20 14:35:0組卷:1引用:1難度:0.7
相似題
-
1.回答下列問題
(1)肼(N2H4)分子可視為NH3分子中的一個氫原子被-NH2取代形成的另一種氮的氫化物。
①NH3分子的空間結構是;N2H4分子中氮原子軌道的雜化類型是。
②肼可用作火箭燃料,燃燒時發生的反應是N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)ΔH=-1038.7kJ?mol-1,若該反應中有4molN-H斷裂,則形成的π鍵有mol。
③肼能與硫酸反應生成N2H6SO4,N2H6SO4與硫酸銨化合物類型相同,則N2H6SO4晶體不存在(填標號)。
a.離子鍵
b.共價鍵
c.范德華力
(2)第ⅥA族元素氧、硫、硒(Se)的化合物在研究和生產中有許多重要用途。請回答下列問題:
①H2Se的還原性比H2S(填“強”或“弱”)。氣態SeO3分子的空間結構為,SO2的VSEPR模型為,空間結構為。
②H2O內的O-H、水分子間的范德華力和氫鍵,從強到弱依次為,H+可與H2O形成H3O+,H3O+中O采用雜化,H3O+中H-O-H鍵角比H2O中的(填“大”或“小”)發布:2025/1/5 8:0:1組卷:21引用:1難度:0.6 -
2.下列化學用語或圖示正確的是( )
A.NH3和 的VSEPR模型和空間結構均一致NH+4B. 的VSEPR模型:SO2-3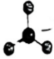
C.丙酮( 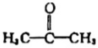 )分子中C原子的雜化類型均是sp2
)分子中C原子的雜化類型均是sp2D.HCl分子中σ鍵的形成: 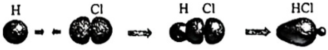 發布:2025/1/5 8:0:1組卷:24引用:2難度:0.5
發布:2025/1/5 8:0:1組卷:24引用:2難度:0.5 -
3.當地時間2020年1月30日晚,世界衛生組織(WHO)宣布,將新型冠狀病毒疫情列為國際關注的突發公共衛生事件,防疫專家表示,75%的醫用酒精、含氯消毒劑(如84消毒液等)可以有效殺滅病毒,佩戴口罩能有效減少感染新冠的危險。下列有關說法正確的是( )
A.制作口罩的原料之一丙烯分子中存在sp2-sp2和sp2-sp3σ鍵 B.乙醇可以和水以任意比互溶的原因只是因為兩者均為極性分子,相似相溶 C.次氯酸的電子式: 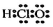
D.乙醇分子中官能團為羥基,在水中形成分子內氫鍵 發布:2025/1/6 6:0:5組卷:6引用:1難度:0.7


