如圖為實驗室用二氧化錳和濃鹽酸為原料制取純凈、干燥的氯氣,并驗證氯氣性質的裝置。其中E瓶放有干燥紅色布條;F中為紅色的銅網。

(1)儀器A的名稱是 分液漏斗分液漏斗。
(2)寫出MnO2與濃鹽酸反應的化學方程式 MnO2+4HCl(濃) △ MnCl2+2H2O+Cl2↑MnO2+4HCl(濃) △ MnCl2+2H2O+Cl2↑。
(3)裝置C中盛裝的溶液是 飽和食鹽水飽和食鹽水,D中試劑的作用是 干燥氯氣,除去氯氣中的水干燥氯氣,除去氯氣中的水。
(4)E中的紅色布條是否褪色?否否(填“是”或“否”),寫出F中反應的化學方程式:Cu+Cl2 △ CuCl2Cu+Cl2 △ CuCl2。
(5)H中的試劑為 NaOH溶液NaOH溶液,其作用是 吸收Cl2,防止污染空氣吸收Cl2,防止污染空氣,寫出H中發生反應的離子方程式 Cl2+2OH-═Cl-+ClO-+H2OCl2+2OH-═Cl-+ClO-+H2O。
(6)氯氣可以用于制備“戰略金屬”鈦,其中有關反應如下,用雙線橋標出反應中電子轉移的方向和數目
 :TiO2+2C+2Cl2 高溫 TiCl4+2CO。
:TiO2+2C+2Cl2 高溫 TiCl4+2CO。
△
△
△
△


高溫
【考點】氯氣的實驗室制法.
【答案】分液漏斗;MnO2+4HCl(濃) MnCl2+2H2O+Cl2↑;飽和食鹽水;干燥氯氣,除去氯氣中的水;否;Cu+Cl2 CuCl2;NaOH溶液;吸收Cl2,防止污染空氣;Cl2+2OH-═Cl-+ClO-+H2O;
△
△

【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/6/28 8:0:9組卷:6引用:3難度:0.7
相似題
-
1.為了驗證干燥的氯氣無漂白性,濕潤的氯氣具有漂白性,某同學設計實驗如圖.其中B、C、D、E、F分別盛有飽和食鹽水、濃硫酸.干燥紅色布條、濃硫酸、濕潤紅色布條.
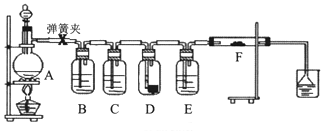
請回答:
(1)E中濃硫酸的作用.
(2)將F中的濕潤布條換成卷曲的細銅絲,并用酒精燈加熱,可看到的現象是.
(3)若用裝置A制取2.24L(標況)氯氣,消耗10mol/L濃鹽酸的體積明顯大于40mL,造成該結果的可能原因有.
A.濃鹽酸的揮發 B.隨反應進行鹽酸濃度下降
C.加熱時火力不夠猛 D.MnO2固體過量.發布:2025/1/15 8:0:2組卷:17引用:1難度:0.3 -
2.如圖是某同學設計的氯氣制備及性質驗證實驗裝置。相關說法正確的是( )

A.脫脂棉中的無水氯化鈣可以用堿石灰代替 B.該實驗裝置可證明干燥的氯氣沒有漂白作用 C.濕潤的紫色石蕊試紙變紅色,說明反應生成了酸性物質 D.濕潤的淀粉碘化鉀試紙變藍色,然后又逐漸褪去,說明氯氣具有漂白性 發布:2025/1/15 8:0:2組卷:20引用:2難度:0.8 -
3.實驗室中模擬用甲烷與氯氣反應得到的副產品來制取鹽酸,原理如圖,下列說法不正確的是( )
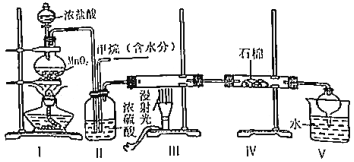
A.依據裝管Ⅰ中的現象控制氣流的速度 B.分離裝置V中鹽酸的最佳操作方法是分液 C.裝置Ⅳ的石棉中可加入一些氫氧化鈉粉末 D.實驗過程中可觀察到裝置Ⅲ中硬質玻璃管內壁有附著的油珠 發布:2024/12/30 17:0:5組卷:61引用:1難度:0.7


