1932年,美國化學大師Linus Pauling提出電負性(用希臘字母x表示)的概念,用來確定化合物中原子某種能力的相對大小。Linus Pauling假定F的電負性為4,并通過熱化學方法建立了其它元素的電負性。LhlusPauhg建立的有關元素的電負性如下:
| H:2.1 | ||||||
| Li:1.0 | Be:1.5 | B:2.0 | C:2.5 | N:3.0 | O:3.5 | F:4.0 |
| Na:0.9 | Mg:1.2 | Al:1.5 | Si:1.8 | P:2.1 | S:2.5 | Cl:3.0 |
| K:0.8 | Ca:1.0 | Ga:1.6 | Ge:1.8 | As:2.0 | Se:2.4 | Br:2.8 |
| Rb:0.8 | Sr:1.0 | In:1.7 | Sn:1.8 | Sb:1.9 | Te:x | I:2.5 |
| Cs:0.7 | Ba:0.9 | Tl:1.8 | Pb:1.9 | Bi:1.9 | Po:2.0 | At:2.2 |
| Fr:0.7 | Ra:0.9 |
(1)寫出元素電負性在上表中同一橫行和同一縱行中的遞變規律:
同周期中從左到右逐漸增大(或同主族中從上到下逐漸減小)
同周期中從左到右逐漸增大(或同主族中從上到下逐漸減小)
(2)預測Te元素x的取值范圍
2.0≤x≤2.4
2.0≤x≤2.4
(3)觀察上表可得出如下結論:一般情況下,金屬元素的電負性越小,它的金屬活動性就越
強
強
(選填“強”或“弱”),該元素的原子 失電子
失電子
(選填“失電子”或“得電 子”)的能力越大。(4)大量事實表明,當兩種元素的x值相差大于或等于1.7時,形成的化合物一般是離子化合物。根據此經驗規律,AlCl3物質
不是
不是
(選填“是”或“不是”)離子化合物。【考點】元素周期表結構及簡單規律.
【答案】同周期中從左到右逐漸增大(或同主族中從上到下逐漸減小);2.0≤x≤2.4;強;失電子;不是
【解答】
【點評】
聲明:本試題解析著作權屬菁優網所有,未經書面同意,不得復制發布。
發布:2024/8/4 8:0:9組卷:300引用:6難度:0.3
相似題
-
1.下表是元素周期表的部分內容,請認真分析并回答后面的問題:
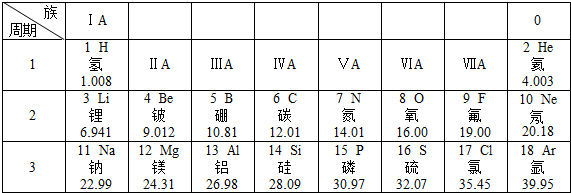
(1)請從上表中查出地殼中含量最多的金屬元素的相對原子質量為.
(2)表中不同種元素最本質的區別是(填序號):
A.相對原子質量不同 B.質子數不同 C.中子數不同
(3)元素周期表中每一個橫行叫做一個周期,通過分析,同一周期元素之間的排列有一定的規律,如:(填字母序號)、…
A從左到右各元素原子的電子層數相同
B從左到右,各元素原子的原子序數依次增加
C從左到右,各元素原子的最外層電子數相同
(4)元素周期表中,原子序數為12的鎂元素的原子結構示意圖如圖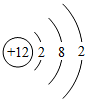 ,該原子在化學反應中易(“得到”“失去”)電子.說明元素的化學性質與原子的關系密切.
,該原子在化學反應中易(“得到”“失去”)電子.說明元素的化學性質與原子的關系密切.
(5)僅含碳和氫兩種元素的有機物稱為烴,如烷烴、烯烴、炔烴等.烷烴中最簡單的是甲烷(CH4),其余隨碳原子數的增加,依次為乙烷(C2H6)、丙烷(C3H8)、丁烷(C4H10)等.如果烷烴中的碳原子數為n,則烷烴的化學式可以用通式表示.它們在氧氣中完全燃燒的產物都是二氧化碳和水,試寫出甲烷在空氣中充分燃燒的化學方程式:.發布:2024/11/26 8:0:2組卷:13引用:1難度:0.3 -
2.如圖是元素周期表的一部分,根據圖表的信息回答下列問題.
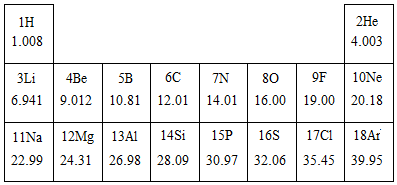
(1)13號元素的名稱為.
(2)相對原子質量為28.09的元素屬于元素(填“金屬”或“非金屬”).F的相對原子質量為.
(3)不同種元素的本質區別是(填字母序號).
A.質子數不同B.相對原子質量不同C.中子數不同
(4)如圖為R3+粒子結構示意圖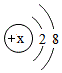 ,則X=,該元素位于周期表中第周期.
,則X=,該元素位于周期表中第周期.
(5)與鈉元素化學性質相似的元素是(填元素符號).發布:2025/1/18 8:0:1組卷:41引用:1難度:0.7 -
3.圖1是元素周期表的一部分,據此回答下列問題.
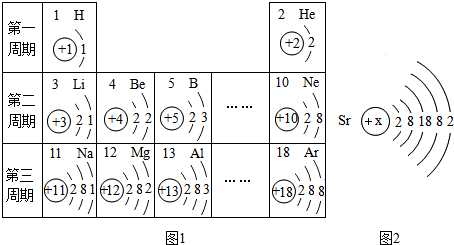
(1)表中13號元素是鋁元素,該元素的原子在化學反應中易(填“得到”或“失去”)電子,形成離子,其離子符號是.
(2)通過上表分析可得出的規律有(寫一點).
(3)圖2是Sr元素的原子結構示意圖,則x=,該元素屬于元素(填“金屬”、“非金屬”或“稀有氣體”),其化學性質與上表中的(填符號)元素相似,通過圖1分析可知,該元素位于元素周期表第周期.發布:2024/12/9 8:0:2組卷:1引用:1難度:0.5


